先日、知り合いの I さんから電話があった。生存確認が理由の一つだと思うが、今回は一つ注文があった。あんたの屁理屈を基礎に「リグニンの物語」を書けという要望が、彼の知り合いからあったという。消えたブログでは書いていたのだが、このサイトとには残っていないようなので、もう一度アップする予定にしていた。ただ、話の流れの都合で「多糖類」について書いた後のほうが話の流れがスムーズになるため、次の次くらいにしようと思っていた。とはいえ、読者からの有り難いリクエストなど滅多にある事ではない。これは是非応じるべきだと考え、順不同の部分はあるがリグニンの存在意義についての分を先にアップすることにした。冒頭の部分、本来なら多糖類の前文に当たるものだが、ここにおいて置く。さらに、リグニンの項目の中で、敵国条項について述べた部分がある。先日書いたとはいえ、私の持つ危機感の表れとして、重複する部分が多いがそのまま残しておくことにする。もう一つ、リグニンに関しては書くべき事がかなり膨大な量となる。従って、その1とその2の二部構成にしたい。では
光の春という表現がある。立春から春分までの時期、気温はまだ低いとはいえ、時折射しこむ陽光の明るさに春の息吹を感じる須臾を捉えた言葉であろう。光の春という言葉が成立するなら、光の夏という言葉はないのだろうか。極めて安易な発想だが、グーグルで「光の夏」を検索しても、私の想いに合致するものは無いようだ。「光の夏」という言葉のつながりから浮かんでくる心証風景があるとすれば、五月晴れの下、照葉樹林に湧き上がる黄緑色の若葉を照らす目映いばかりの風光である。
急に現実的な話に戻るが、この時期の紫外線強度は盛夏の頃と殆ど変わらない。その紫外線の下で咲き乱れる花々は、どのようにして紫外線傷害を回避しているかとの問題意識を底流にして、植物の色素についての文章を書いた。論を尽くしたとは言い難いが、植物色素に対する基本的考え方は間違っていないと考えている。この章と通底する部分がありそうなので。興味のある方は読み返して欲しい。https://bamboolab.yamasatoagr.com/?p=7160 「花の色素に関する考察」参照の事
さて、このブログページの右上に、Noisy Minority and Silent Majority というフレーズを入れている。別に政治的意図があって入れたわけではない。Silent Majority とは、1969年のベトナム反戦運動が盛んであったアメリカにおいて、当時大統領であったニクソンが使ったフレーズである。声高に反戦を叫ぶ若者達に対し、この言葉は静かに彼を支持してくれる穏健な多数派の国民を意味していた。Noisy Minority はこの反対語であり、少数派でありながら声だけは大きいグループを意味する。なかなかにいろんな使い方ができる政治的用語である。実はこのタイトル部分を書き直そうと思っているのだが、変更の仕方がいま一つわからない。検索用のキーワードの設定ができればと望んでいる。
生物の体内で生起する多種多様な化合物群を、まとめて代謝物(Metabolites)と読んでもいいだろう。代謝物を分類する方法にはいくつかの種類がある。もっとも良く使われるのは、生合成のプロセスを基準とするものである。これは酢酸-マロン酸系に属する、あれはテルペンだ、それはシキミ酸経路に由来するなどとして、化合物群をグループ化していく。この分類においては、構造的類縁性は局所的には担保される。但し、この分類と生理活性を組み合わせた分類を試みようとしても、極々局所的には成立するかもしれないが大局的には全く成立しない。
代謝物を一次代謝物、二次代謝物として、生理的意義に基づいて分類することもよく行われる。この分類の説明は、何気なく聞くと何となく分かった気になるのだが、この概念に従って代謝物を分類することははなはだ難しい。代謝系の中途に現れる生存に関係ないと思われる二次代謝産物の連なりの後に、重要な生理活性を持つ(一次代謝産物)が忽然と現れるのである。その概念は内部に矛盾を含むのではと話し始めると、まあそういう堅いことは言わずに、歴史的経緯もあるからと遮られる場合が多い。学問的基盤が不安定であるにもかかわらず、使われてきた歴史の長さに依存した暗黙の前提の上に成立している概念のようだ。
もっとも分かりにくいのが、代謝物を中間代謝物(中間体)と最終代謝物(目的物質)に分類する方法である。自らが問題として設定した代謝物を最終生産物とし、そこまでに出現する物質群を中間生産物と規定するこのやり方においては、A氏の中間代謝物はB氏の最終生産物となって当然である。ここには、代謝物全体を見るような総合的視点は欠片も存在しない。構造主義的立場からすれば最も唾棄すべきやり方だと思うが、学会用語として意外に蔓延っているのが不思議な気がする。
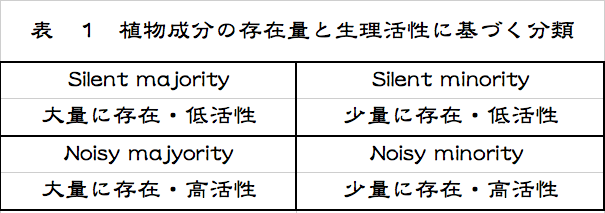
これ以外にもいろいろな捉え方があるが、どれも帯に短したすきに長しという状態であろう。私も長い間、合理的な分類法はないのかと模索を続けてきたが、全てを矛盾なく包含するような精確な分類法は思いつかない。寧ろ、そんなものはないと考えるのが正しいのではないかと思い始めている。とはいえ、考え続けてきた結果が何もないでは寂しいので、一つだけ紹介する。植物についての話となるが、代謝物を植物中の存在量と生物活性を指標として分類するという方法である。低活性と書いているものは無活性も含む。
植物の代謝物を、セルロース、ヘミセルロース、リグニン、デンプンなどに代表される多量に生産され蓄積される物質群と、オーキシン、ジベレリン類、サイトカイニン、エチレン、アブシジン酸などに代表されるごく少量しか生産されず蓄積もされない物質群などに分けたのである。今更といわれかねない馬鹿馬鹿しい分類だが、この分類に隠れている現象をよくよく考えると、まんざら馬鹿馬鹿しいとも言えない。色々な代謝物がもつ植物自身に対する生理活性を加味して考えると、低活性あるいは無活性の代謝物であれば少量であろうと大量であろうと存在してもかまわないが、高活性の化合物は少量あるいは微量でないと存在は許されないに違いない。自家中毒を起こしてしまうだろう。ある代謝物の持つ生理活性が、その物質の存在量に縛りを掛けているのである。こうした捉え方はなかったように思うが、どうだろうか。
研究という立ち位置からこれらの代謝物を見た場合、最初にテーマとして選ぶのは微量で高活性の代謝物を選ぶのは当然のことであろう。いわゆるNoisy Minority として分類される物質群である。一方、大量に存在するにもかかわらず明らかな生理活性が認められないために、軽視され続けてきたリグニンやデンプンのような物質群がある。「リグニンやデンプンを軽視してきたことはない、重要な生物資源ではないか」とする反論があるかもしれないが、それは他の生物(人を含む)にとってという極めて功利的な意味での興味であったろう。視点が違うのである。植物にとってのリグニン、デンプンという立場からの研究量が、植物にとっての微量生理活性物質ー例えば植物ホルモン類ーという研究の量と比すべきもないのは明らかである。私は、こうした低活性あるいは無活性で多量に存在する物質群をSilent Majority と比定したわけである。
Silent Majority は、穏健で異論を吐くでもなく黙々と働き、社会を構成し、素直に納税する大衆を指す。では、Silent Majority と比定された物質群は何をしているのか。この問いこそが、私が永年持ち続けた問いであった。何故そういう問いを持つのか?それは、これらの物質に対して現在行われている説明のなかに、嘘と論点のはぐらかしを感じるからである。追々、この問題には触れることにしよう。それにしても永年生きてきた巨樹の持つ風格と荘厳さは素晴らしい。しかしいかに巨大な幹を持つとしても、 生きているのは幹の外縁の2〜3 cmにある組織に過ぎない。リグニンやセルロースが主体となるその内側は死んだ細胞の集積物である。千年を超える樹齢を持つ巨樹は、千年以上にわたって自らの死と同居してきたわけである。光の夏、自らの死を内包した巨樹の生き生きとした姿は哲学的でさえある。
そこでリグニンだが、まず常識に従ってリグニンがどのような物質で、どのような意義付けがなされているかを概説しよう。リグニンは木材の乾燥重量の20~30%を占めるフェノール性の高分子物質である。そして一年間に地球上でつくられるリグニン量は、推定だが200億トン以上にもなるという。この値は多糖類であるセルロース・ヘミセルロースに次ぐものであり、バイオマスとして極めて大きな値である。時に誤解をされている場合を散見するが、リグニンを作るのは樹木だけではない。イネ科植物はかなりな量のリグニンを作るし、マメ科植物であるアルファルファも作るなど、草本であってもリグニンの生合成を行う。
生合成の最終段階で、数種のリグノールと呼ばれるモノマー分子がペルオキシダーゼ、あるいはラッカーゼにより酸化される際に、いくつかの部位に発生するラジカル間のランダムカップリング反応であるため、一定の構造を持たない極めて複雑な構造を持つ分子量が10,000を超えるポリマーとなってしまう。(50,000を超えるとする説もある)とはいえ、リグニンの分子量は抽出する溶媒によって大きく変動するし、分子の組成も一様ではないため、一義的に正しい分子量が決められるわけではない。
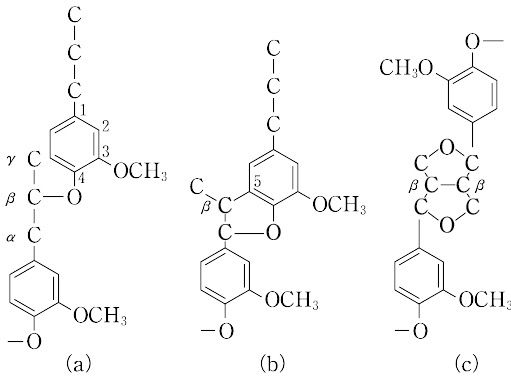
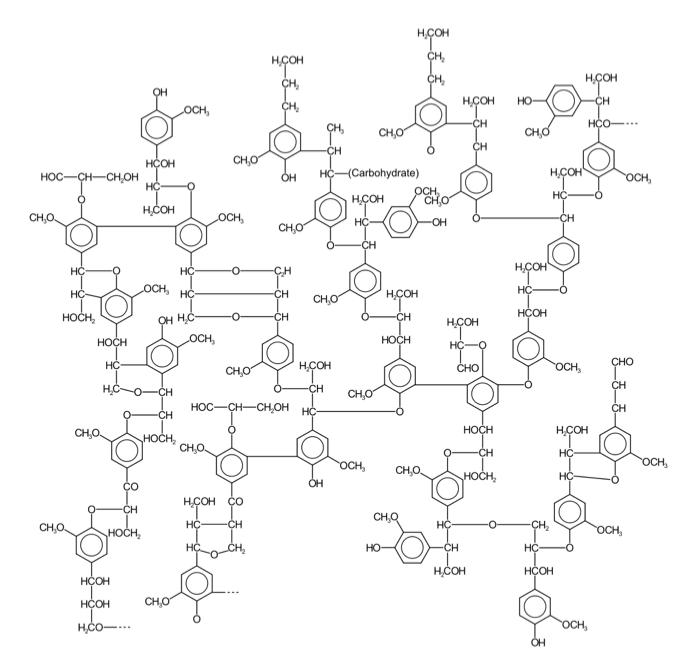
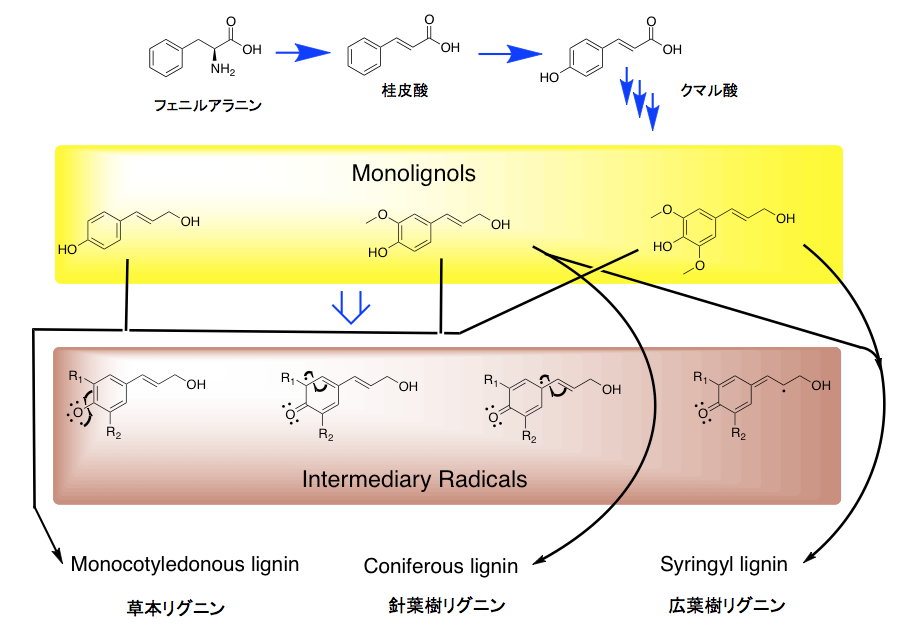
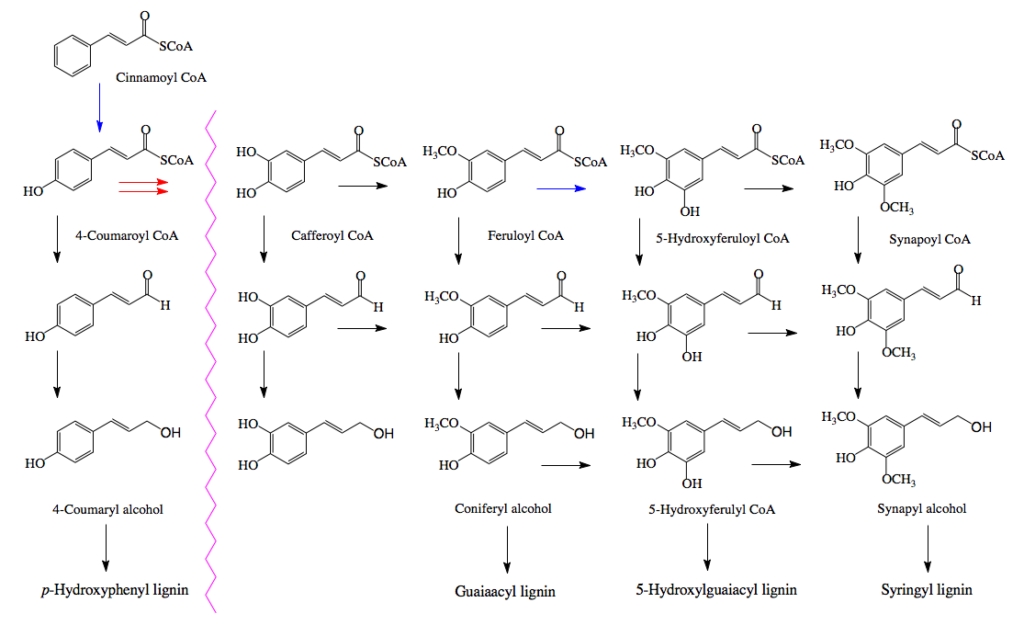
図1リグニンの構造の極一部 K. FreudenbergとA. C. Neish「Constitution and Biosynthesis of Lignin 」より そして、このリグニンがセルロースやヘミセルロースの繊維の間に沈着して細胞壁を形作り、植物の体制の維持に働いていると説明される。セルロースやヘミセルロースが鉄筋にあたりリグニンがコンクリートに当たるという説明がなされる事もある。ともあれ、リグニンの構成成分は植物種によって少しづつ異なり、裸子植物である針葉樹が含むリグニン(針葉樹リグニン)はコニフェリルアルコールからの重合物で構成され、広葉樹が含むリグニン(広葉樹リグニン)は、コニフェリルアルコールとシナピルアルコールを原料とする共重合物で構成される。イネ科植物に含まれるリグニンは、コニフェリルアルコールとシナピルアルコールだけでなく4-p -クマリルアルコールを含むリグノール類の共重合物であり、草本リグニンと呼ばれることもある。この辺りの知識は、木材化学あるいは林産化学などと呼ばれる分野の研究者が豊富に持っているに違いない。
図2 リグニンの種類と生合成の簡略図
まずヒトにとっては必須アミノ酸であるフェニルアラニンに、フェニルアラニンアンモニアリアーゼ(PAL)が働いて桂皮酸が生じるところから系は始まる。こう書けば植物細胞中で起こる何でもない一つの反応のように聞こえるが、この反応の凄味は物質量で見ないと分からない。何しろリグニンだけで年に200億トン以上、リグナン、クマリン、スチルベン、フラボノイド、一部のアルカロイドなど極めて多種かつ多量の化合物群がこの系を通って生合成される。植物界においては、思いもよらぬほど莫大な量のフェニルアラニンが作られ、この系を通って消費されているのである。植物は静かな生き物だという捉え方が一般的だが、そんなことはない。植物とはセルロース、ヘミセルロース、デンプン、リグニンなど膨大な量の物質をダイナッミックに生産・蓄積・消費し続けている、極めて能動的な生き物なのである。
さらに我田引水的議論をするとすれば、フェニルアラニンがPALによって脱アミノ化される時、フェニルアラニンと同じモル数のアンモニアが生産され、このアンモニアはグルタミン酸生合成を中心とする種々のアミノ酸の生合成系の中で再利用されている。これこそが、私が先のブログで提唱した「窒素サルベージ系路」である。
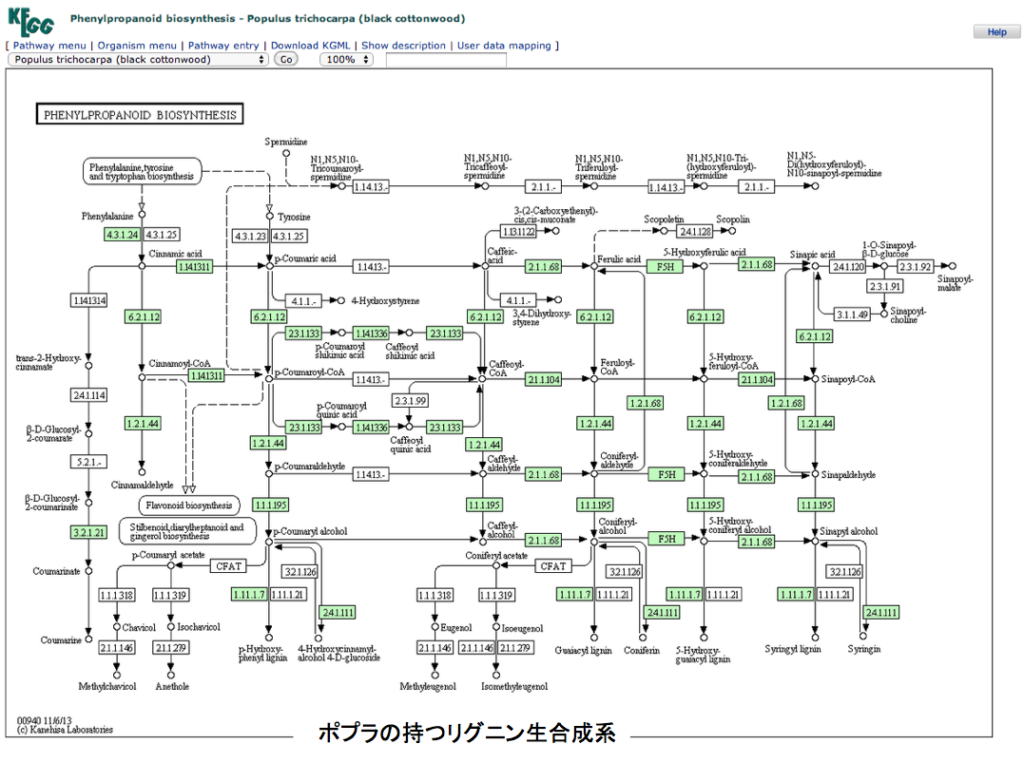
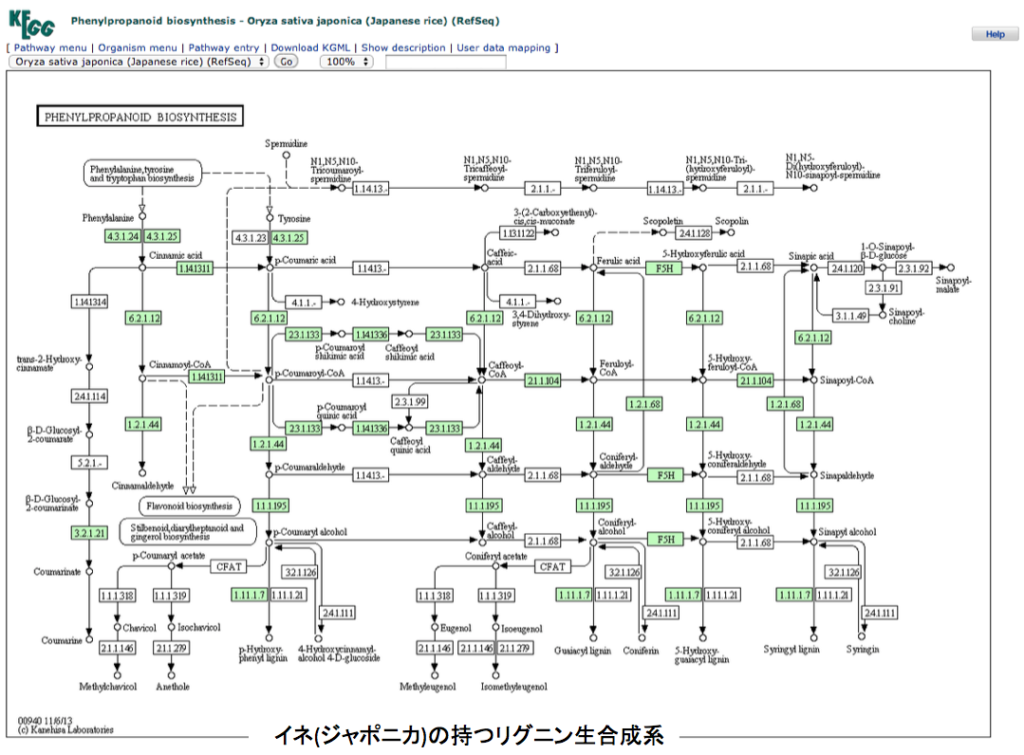
さて、御託を並べることなく、フェニルアラニンからリグニンまでの2つの代謝マップを示すことにする。一つはポプラで動いているリグニン合成系、いま一つはイネ(japonica)で動いているリグニン合成系である。両図とも、いつものようにKEGGからの引用であることをお断りしておく。各物質が変換されるとき働く酵素で、その植物に存在する場合に酵素番号の枠内が緑に着色してある。
図3 ポプラの持つリグニン生合成系 図4 ジャポニカ種のイネが持つリグニン生合成系 できればKEGGの原図を見てもらったほうが分かりやすい。まず見て欲しいのは、フェニルアラニンからリグノールと総称されるp -クマリルアルコール、コニフェリルアルコール、5-ヒドロキシコニフェリルアルコール、シナピルアルコールまでの系路である。これらを眺めてすぐに気付くのは、チロシンからp -クマル酸への経路がイネには存在するのにポプラには存在しないことであろう。この点についてはイネの方が植物界における少数派で、他の植物にはこの系は存在しないようだ。但し、以前に述べたように、PALがフェニルアラニンに対する速度より遙かに遅いとはいえ、チロシンをp -クマル酸に変換している可能性は残っている。もう一つ注意喚起だが、人においてフェニルアラニンは必須アミノ酸だがチロシンは必須アミノ酸ではない。理由は、フェニルアラニンは人の体内で酸素添加酵素の働きにより、チロシンへと変換されるからだ。ところが殆どの植物においてこの反応は起こらず、チロシンはアロゲン酸系路を通って生合成される。つまり植物体内においてフェニルアラニンとチロシンは構造が似ているとは言え全く別種のアミノ酸として考えなければならない。委細はhttps://bamboolab.yamasatoagr.com/?p=6045 において議論している。
大学院の頃、いくつか読んだ論文をまとめ自分が行った研究であるという観点から発表させられる輪講という科目があった。当時から少数派であったらしい私は、常に自分の研究テーマと関係の薄いことばかり選んで発表していた。当時発表されて間もない「中立進化説」をこれは面白いと紹介したにもかかわらず、全く理解されなかった記憶がいまも鮮明に残っている。但し、いまになってみれば、本人の理解が十分でなく説明が余りにも稚拙だったことも原因であったようだ。その頃、リグニンの生合成についても話した記憶がある。K. FreudenbergとA. C. Neishの著書である「Constitution and Biosynthesis of Lignin 」をネタ本として当時としては最新の論文をいくつかまとめて話したのだが、本音はFreudenbergの本に描いてあったリグニンの推定構造式(図 1)に惹かれたにすぎない。それ以来、自らの研究テーマとは殆ど関係なかったにもかかわらず、リグニンに関する報告はある程度フォローしてきた。その記憶を辿りながら話を進めることにする。
さて、解糖系やTCA回路を眺めると、これらの代謝系は基本的には一次元の系と考えられる。これらの系と図3,図4に示した2つのリグニン生合成を比較すると、リグニン生合成系は二次元の広がりを持つように見える。(三次元かもしれない)フェニルアラニンからリグノールと総称される3種の中間体(p -クマリルアルコール、コニフェリルアルコール、シリンギルアルコール)に向けて、拡散していくネットワークである。このネットワークで横糸に相当するのが、オキシゲナーゼによる酸化とそれに続くフェノール性水酸基のメチル化反応の繰り返しであり、縦糸に相当するのがカルボキシル基からリグノール類へと連なる還元反応である。
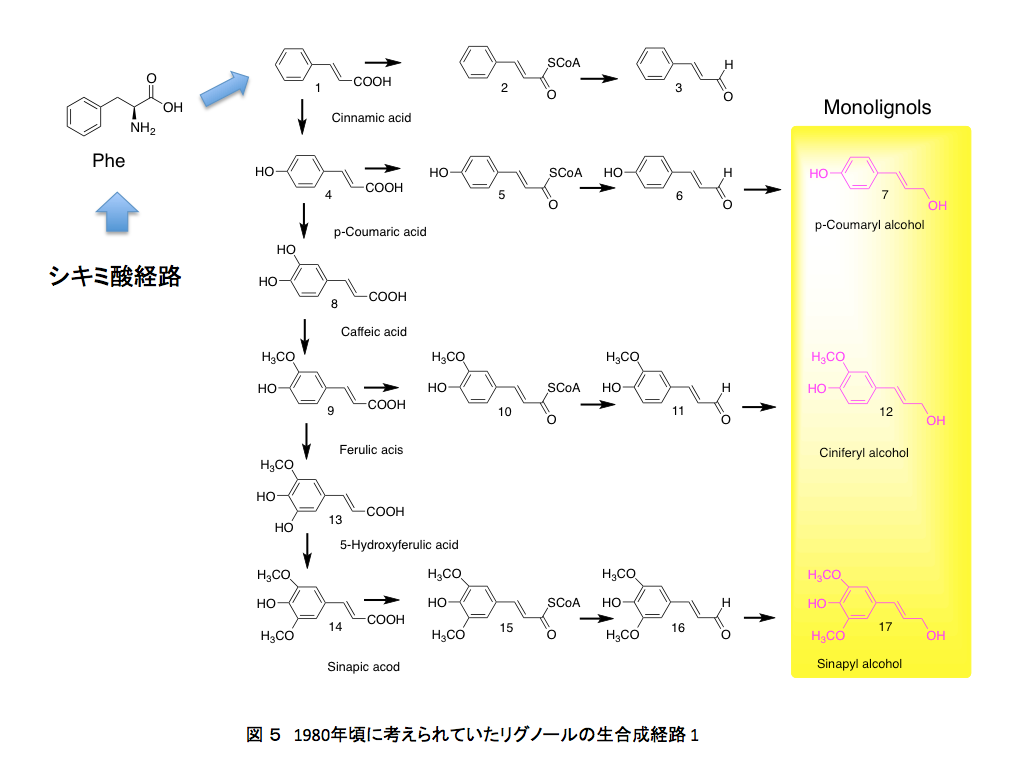
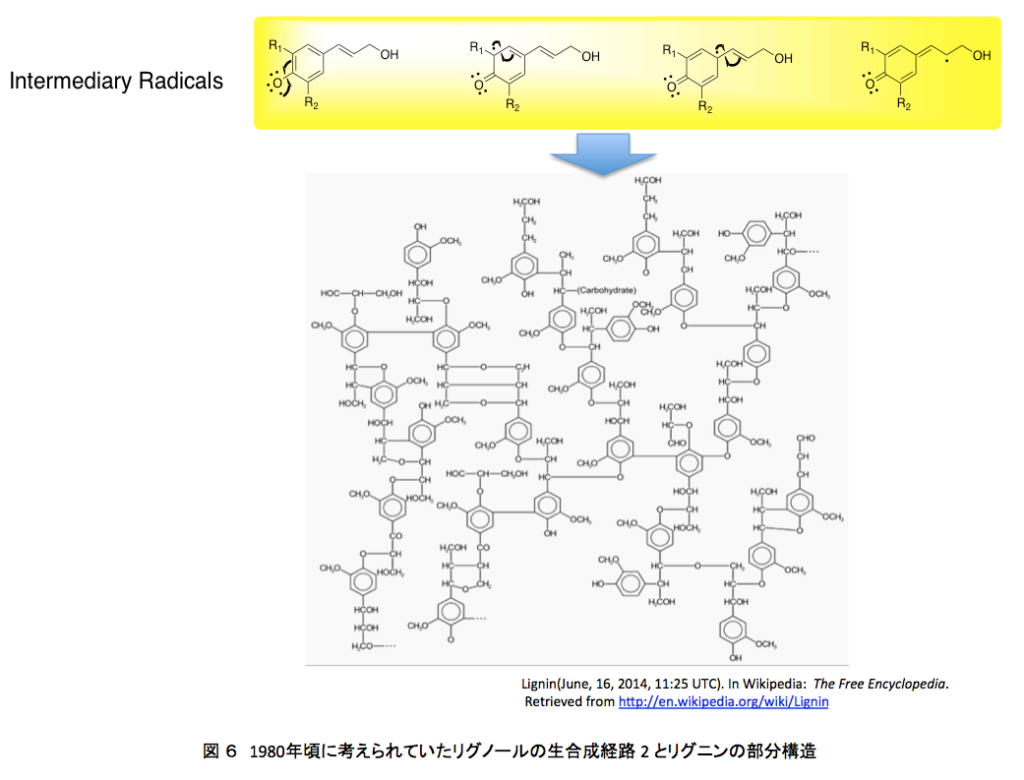
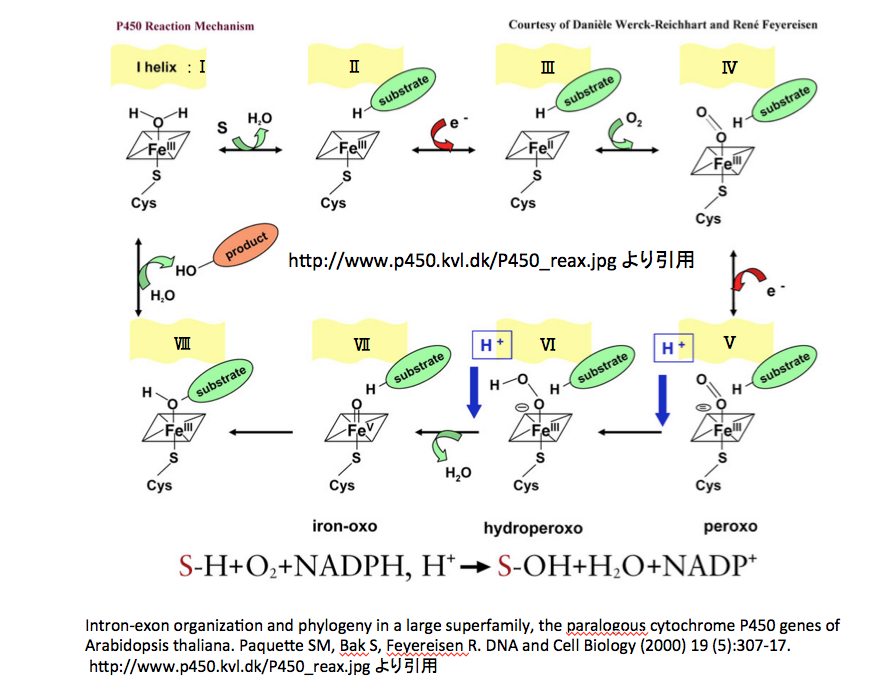
1980年代においては、リグニンの生合成は図5と図6に示すように進行すると考えられていた。
フェニルアラニンから作られた桂皮酸が、水酸化酵素の働きでp -クマル酸、コーヒー酸となった後、3位の水酸基がメチル化を受けフェルラ酸に、フェルラ酸の5位がもう一度水酸化を受けた後メチル化されてシナピン酸を与える。こうして生合成されたp -クマル酸、フェルラ酸、シナピン酸がATPを消費しながら反応性の高いCoAとのチオールエステルを形成したあと、アシルCoAレダクターゼによってアルデヒドに、生成したアルデヒドはアルコールデヒドロゲナーゼによってリグノールと呼ばれるリグニン前駆体まで還元される。
そしてリグノールの4位の水酸基がペルオキシダーゼあるいはラッカーゼによる酸化で発生したラジカルが、共鳴によって分子内の何カ所かに移動した後、ラジカル間のカップリングにより、図1に示した構造に向かってランダムな重合が進むのである。この種の推定構造が、若い頃の私を魅了したモノである。それにしても、この推定構造に魅了される感受性をいつどこで身に付けてしまったのか?いまでは少しまともになった。ChemDraw Ultraを使って色々な式を書いてはいるが、さすがにいまとなっては面倒で、これを真似して自分で描く気にはならない。普通の人なら気にも留めないと思うが、テトラヒドロフラン環の形が歪なだけでなく原子間の結合距離がほぼ現実を無視して描いてある。若ければそのあたりを補正しながらトライしたかもしれない。
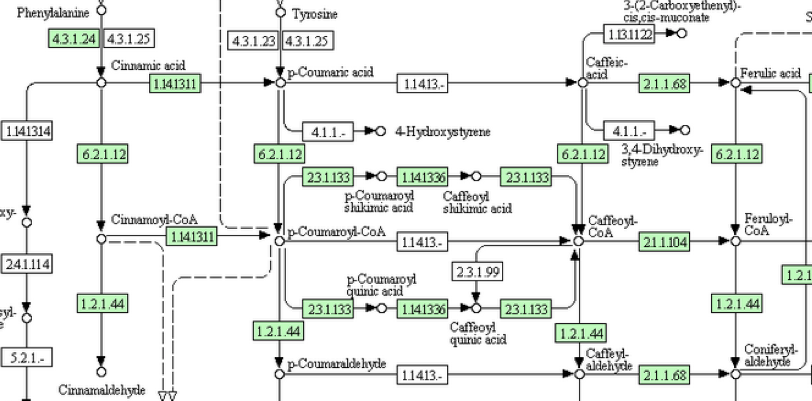
図5・6のスキームを通って反応が進むのなら素直に納得できるのだが、図3・4の対応する部分をよく見てみるとどこか違う。この反応のどこに異和感を感じたのか。図7に図3の該当する部分を拡大して示す。
図7 イネでもポプラでも p -クマル酸とコーヒー酸をつなぐ系が働いていないだけでなく
図7において何となく不思議な系路は図5における化合物5から化合物10、化合物10から15への直接変換系の存在である。これはまあそんなものかと納得すればいい。より重要ないま一つの問題は、イネにおいてもポプラにおいても p -クマル酸とコーヒ酸を繋ぐ系もコーヒ酸とフェルラ酸を繋ぐ系も働いていないのである。図5においては化合物4 から化合物8 、化合物8から化合物9への系路がない事を意味する。コーヒー酸が生合成されないとその後のリグニンに向かう反応は動かないはずである。
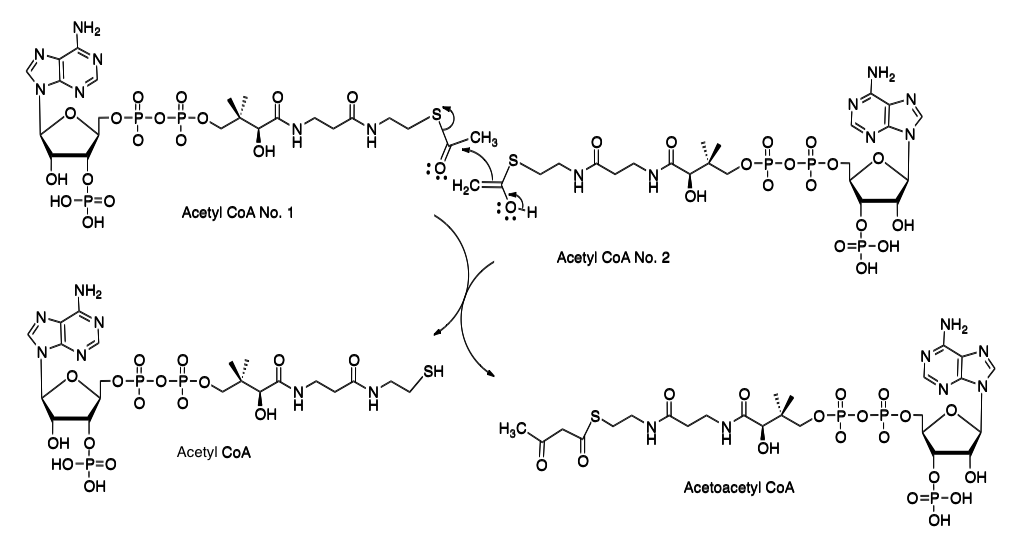
まず、最初の異和感から片づけよう。生体内でカルボン酸がアシルCoAと総称される化合物群へ変換された場合、通常次に起こる反応はカルボニル基上の正電荷に由来する反応、あるいはカルボニル基の α炭素上に発生するアニオンに由来する反応である。例として、テルペン生合成系の初発反応とされる2分子のアセチルCoA間で起こる縮合反応を例として、図8に示している。
図8 アセチルCoAからアセトアセチルCoAへの変換
ここにおいて、アセチルCoAのNo.1分子がカルボニル基上の正電荷に対する求核攻撃を受け、No. 2のアセチルCoA 分子がエノール化によってα炭素上に生成した求核体分子として機能している。要するに、チオエステルのカルボニル基はエステルとはいうもののケトンに近い性質を持ち、カルボニル基の反応性が高いことが知られている。ところが、上記の報告においては、生成した4-ヒドロキシp-クマロイルCoAにおいては活性化されたカルボニル基を全く無視して、4-ヒドロキシp-クマロイルCoAの芳香環の3位に水酸基の導入が起こるだけでなく、その水酸基がメチル化をうけたフェルロイルCoAまでの反応とフェルロイルCoAからsinapoyl CoA までの反応が進んでいるのである。図9参照のこと
図9 もちろん、ここで働くオキシゲナーゼが、CoA残基を含むp -クマロイルCoAに、カフェロイルCoA O-methyltransferaseがカフェロイルCoAに親和性を持つからだと云われれば、それ以上の反論をする根拠を持っているわけではなかった。如何に異和感があろうと事実は事実である。
異和感を感じたもう一つの事実は、図9において青色の矢印と赤色で示した矢印に対応する反応はベンゼン環上の水酸基のオルト位に対する水酸化反応であり、そのメカニズムは同じと予想される。ところが、予想に反して赤の矢印で示される反応は思わざる進み方をするのである。反応自体はオキシゲナーゼによる水酸基の導入なのだが、その酸化を起こす用意の反応が信じられないほど面白い。この反応の面白さというか意外さについては、後で詳しく述べる事にする。
少しだけ横道にそれてしまう注釈だが、違和感と異和感の使い分けである。多くの国語辞典が異和感は誤りで違和感が正しいとしているとはいえ、新明解国語辞典では異和感の表記を認めている。「違」と「異」、私の理解では「違」には何か正しいものがあってそれとは違うというというニュアンスを、「異」には相互に異なるだけでどちらが正しいかについての判断がなさそうなニュアンスを感じている。これは私の感性のもたらすものに過ぎず、正しいと主張するつもりはない。ただそうした含意を持つと思うが故に異和感という少数派の言葉を選んでいる。
(このブログでは、政治的なことは書きたくなかった。それが本音である。しかし、見ていられないほど劣化した政治と白痴化したマスコミを見て思わず筆が滑ったのが実情である。以下のフレーズは、2014年に書き一部加筆したもので、数日前書いた文章と大部分が被ってしまうが、まあ私が感じている危機感についての独白として残しておく。いま、日本の歴史と文化と言語と国土と国民を大事にしろと言うと極右と呼ばれ、そのためにこの国は何をしているんだと政府を批判すると極左と呼ばれる。フランスのルペンと似た立場にいるのかもしれない。)
居心地が悪いと言えば、ここのところの政治状況の居心地の悪さは半端ではない.技術論をやっていると、政治論にすり替えて批判するヒトが増えてしまった。原子力発電の話でも、事故というモノは技術につきまとう影のようなモノで、これを根絶させることはできないと考える。
新たな技術を実用化したとき、故障あるいは事故の発生数は故障率曲線と呼ばれるバスタブ型の曲線に乗った形で推移する。当初の思いがけない原因で生起する初期故障群、安定期に入ったときに起こる偶発故障群、そして経年劣化によって起こる老化に由来する故障群である。そして、ハインリッヒの法則に従って大事故が起こる。
事故が起こったとき、原子力以外の事故であればその場を片付ければその土地の利用はすぐに可能になる。そういう意味で、もし事故が起こった場合多数の人命が失われることが推定されるにしても、限度を超えない範囲であれば巨大な航空機であろうと新幹線であろうと、仕方ない事として認めざるをえない。しかし、原子力発電においては、事故を起こした場合、あるいは起こった場合、広大な土地の利用が極めて長期にわたって不可能となる。国土が失われることと同じ意味である。勿論、現在使われている原子炉より安全といわれているトリウム炉が本当に安全であるのなら、それを否定することはしない。しかし、十分な実証試験がなされなければならないと思う。エネルギーが足りないからと緊急証認で走り出すのでは、コロナワクチン問題の二の舞いを演じる事になるだろう。
そういう立場から現状の原子力発電は望ましくないと考えているが、そうするとあなたは左翼だと云われるのである。日本の国土を、できるだけ汚さずに維持したいと考えると、左翼に分類されるらしい。この分類は上記の理由とは全く関係なく、政府の方針に従うか従わないかで決められている。声高にそういう判定をする人は半減期の意味も生物濃縮の意味も放射能障害の実態についても全く知らない。沸騰水型原発と加圧水型原発なんてその用語さえも知らない。無知の人は無敵の人である。とても敵わない。私は学生の頃から考え方はほとんど変わっていない。進歩していないと云うべきかもしれないが、当時私は右翼と云われていた。
そう、最近の集団的自衛権の問題でも、左翼と認定された。理由は簡単である。もう一寸考えた方が良いのではと云ったためだが、巷間云われていることとは別に3つの疑問を持っている。一つは、自衛官の身分の問題である。外国では自衛隊のことをJapan army(日本軍)として扱っているようだが、歴代の総理は自衛隊は軍隊ではないと云う立場であったと思う。国内法では軍隊ではないと規定してある。そこで疑問だが、自衛隊員が万一捕虜になった場合、彼は「捕虜の待遇に関する条約」すなわちジュネーブ条約の保護条項の適用を受けるのだろうか?受けられないとしたら、余りにも自衛隊員が気の毒であろう。あなたの国の歴代の総理は自衛隊は軍隊ではないと云う立場を表明していた。従って、あなたはジュネーブ条約の適用を受けないと宣言され虐待を受けるような事があってはならないと考える。
二つ目は国連憲章における敵国条項の問題である。何カ所かに分かれて書いてあるのだが、もっとも明確に書いてあるのは53条である。ここには、《第二次世界大戦中に「連合国の敵国」だった国が、戦争により確定した事項に反したり、侵略政策を再現する行動等を起こしたりした場合、国際連合加盟国や地域安全保障機構は安保理の許可がなくとも、当該国に対して軍事的制裁を課すことが容認され、この行為は制止できない》と書いてある。もちろん、ドイツ、日本などが1995年にこれらの条項廃止を求めた決議案を国連総会に提出し、賛成多数で採択されたことは知っている。しかし手続きの煩雑さも相まって、この条項はまだ国連憲章中に記載されたままである。例え死文化したと考えられている条項であっても、現実に憲章中に残っている条項はいつでも使えると考えるのが筋であろう。政府はこの件をどう考えているのか、寡聞にして聞いたことがない。
三つ目は、言いがかりといわれるかもしれないが、法の上に立つ憲法を、解釈改憲という形で変更しようという話が進んでいるとき、閣議決定の小さな文言を議論するあほくささである。まあ、両与党ともに落としどころを探しあぐねたあげくの結論だとは思うが、そうしたみえみえの芝居は見たくない。歴史と現実を見据えた本格的議論をすべきだろう。それにしても、ワールドカップで早めに敗退した日本チーム、政府はもう少し勝ち残って政治関連のニュース枠を削ってくれることを期待していたのではないだろうか。
私は、日本の伝統と文化は大事にしたい、日本人を大事にしたいと思っている単純な中道やや右くらいの位置にいるつもりだったが、政府の言う事に反対するやつは左翼だという風潮の中で、いつの間にか左に押し出されそうである。
さて、まじめにCYP84の話をしよう。ややこしいと云えば、Cytochrome P450という一群の水酸化酵素も、実にややこしい。にもかかわらず、知名度は抜群である。調べてみると1964年に還元型酵素の活性中心にある鉄原子に一酸化炭素が配位すると450 nm の光を吸収するため、Pigment 450 と命名されたそうである。私は、長い間 Protein 450(450 nmの光を吸収するタンパク質)の略であると思っていた。学生の頃、サイトカイニンについて何か読みたいと思ってサイトカイニンという書名の本を買った。電車の時刻が迫っていたので、中身は見なかった。家に帰って本を開くと、サイトカイニンではなくサイトカインについての書籍だった。まあ似たような早とちりである。しかし、その本を読んでいたおかげでコロナワクチンの問題点についての理解が早かったと思う。人間万事塞翁が馬、寄り道は寄り道ではない。
さらにだが、Cytochromeというタンパク質の分類群の中にCytochrome P450は含まれない。Cytochromeは電子伝達系で働くタンパク質であり、Cytochrome P450はCytochromeと同じくヘム鉄錯体を持ってはいるが、多種多様な物質に水酸基を導入する水酸化酵素群を意味する。話がここで済むのなら大したことはないのだが、まだ先がある。Cytochrome P450と分類されるオキシゲナーゼの反応メカニズムがまた難しい。難しいと云うより、よく分かっていないというのが現状であるかもしれない。かなり丁寧に探したつもりだが、電子伝達を明確に書いた書籍、論文はほとんどないし、ネットに掲載されているものも、些か不十分なようだ。
さて、本論に戻るが、カフェイルアルデヒドからシナピルアルデヒドへの変換は、F5H (Feluric acid 5-hydroxylase)とよばれるCYP84 familyに含まれる酵素が働くが、この酵素はコニフェリルアルデヒド、コニフェリルアルコール、フェルラ酸を基質として、それらの芳香環の5位に水酸基を導入する。F5Hについては、遺伝子配列、アミノ酸配列など分子生物学的なデータ、酵素学的なデータは明らかにされている。しかし、反応メカニズムについては納得させられる説明がほとんど存在しない。例えば
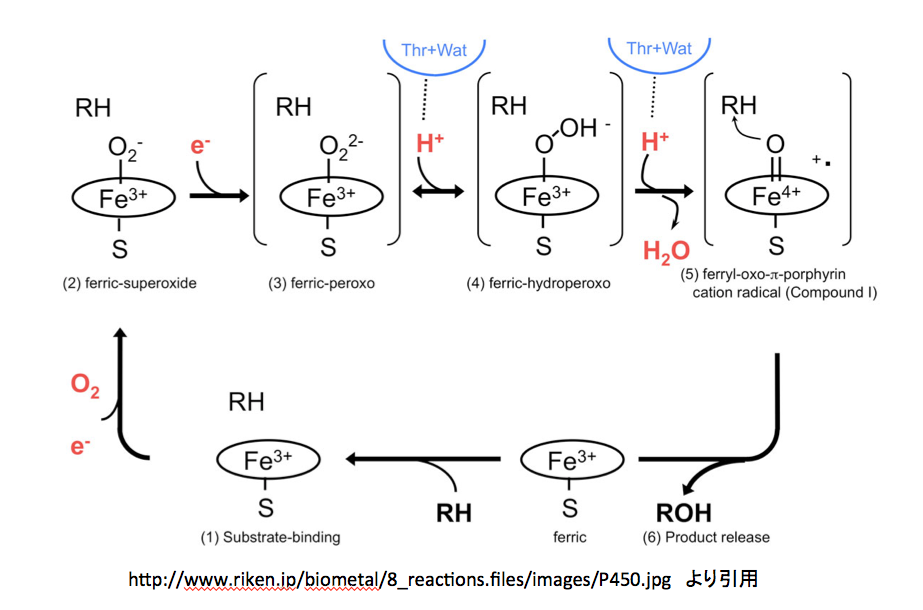
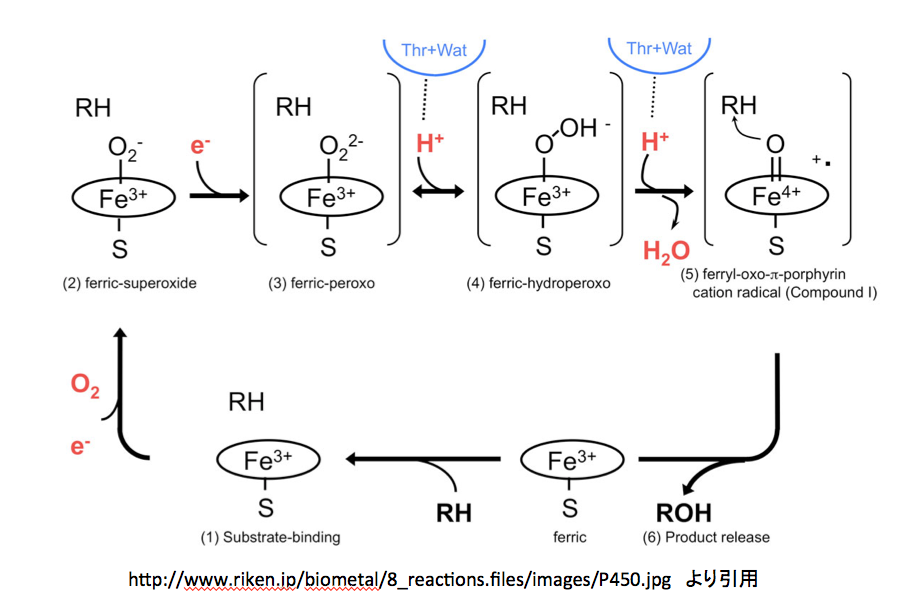
http://www.riken.jp/biometal/8_reactions.htm
にはmetalloenzyme の反応としてP450の反応メカニズムが示してある。このページを図10に示す。
図10 理研のグループが提出しているP-450の反応機構
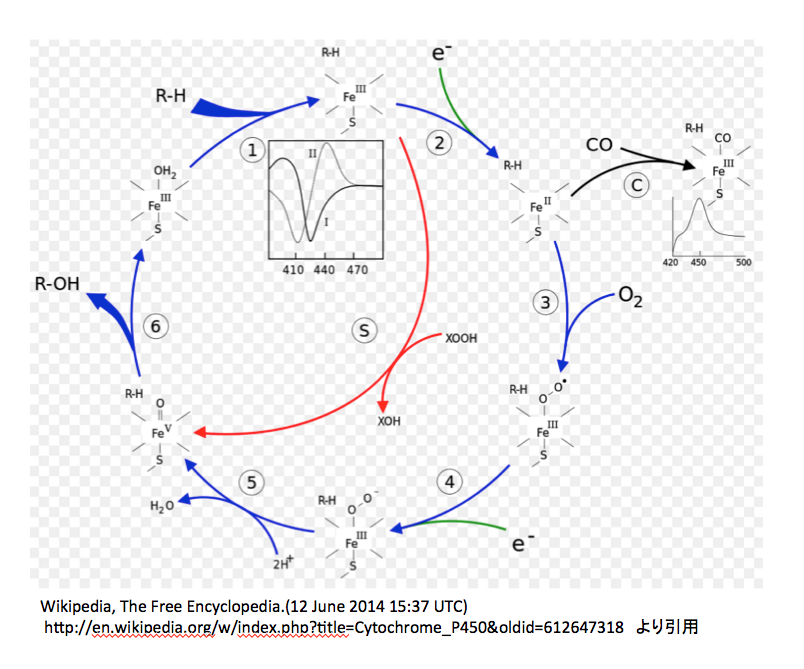
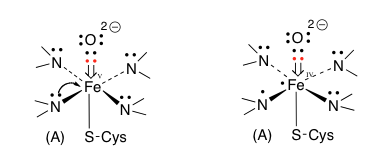
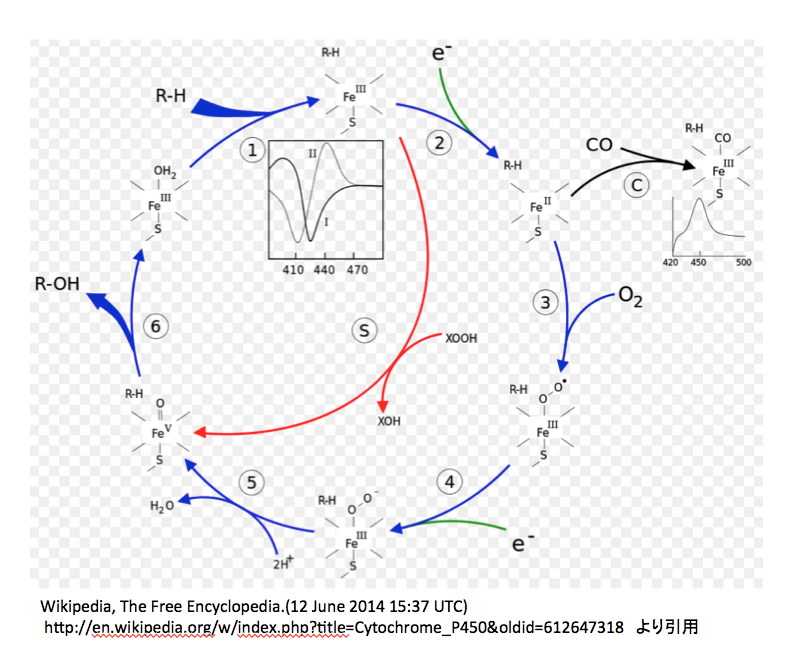
図11には http://www.p450.kvl.dk/p450.shtml に描いてあるアラビドプシスのCytochrome P450の反応メカニズムを、図12には英語版Wikipediaにおいて示してある図を載せておく。(http://en.wikipedia.org/wiki/Cytochrome_P450 )
図11 Paquette SM, BakS, FeyereisenR.が提出しているP450の反応メカニズム
図12 英語版Wikipediaに載っているP450の触媒サイクル
P450のタンパク質部分のグラフィックスに関しては、掃いて捨てるほどの情報が溢れているのに、反応中心であるヘム部分での反応については、適当に書いたとしか思えないいくつかの図があるのみである。図10から図12はある程度のリスクを冒して描いていることを評価すべきであるとはいえ、それらの図で私が納得できるかと云えば、納得できない。いや、理解できないのである。
オキシゲナーゼが関与する酸素添加反応―酸化還元反応においては、鉄錯体が関与している場合が多いのだが、鉄は遷移金属であり固定した原子価を持つわけではない。その鉄原子がポルフィリン環の中央に位置したヘム鉄錯体を形成して、いくつかの原子価を取りながら反応に関与する。
そこまでは良いのだが、錯体化学における反応の表記法においては通常の電子論とは違う点があるように見える。錯体化学において、中央の鉄原子が配位子から電子対を受け入れて配位結合が成立した場合、結合が出来たとは見るものの鉄原子の原子価は変化しないように描く。ここが通常の電子論的表記と異なるため、違和感を感じている。従って、1つあるいは複数の電子が直接鉄原子から移動しない限り、配位子の出入りがあっても鉄原子の酸化状態は変化しない。さらに、起こる反応を説明するために、鉄の酸化状態が異なる共鳴構造を描くことが許されているようだ。もちろん、分光学的データに矛盾しない範囲での話である。
グダグダと文章で説明しても、非常に分かりにくい部分である。図10 から12 まで順に見てゆきたい。間違っているかもしれないと指摘する部分があるかと思うが、私が間違っている可能性あるいは蓋然性も十分にあることを先に断っておく。そこで図10である。
図10 理研のグループが提出しているP-450の反応機構 まず、3価と鉄イオンの周りに描いてある楕円、これがポルフィリン環を示すのは当然として、下向きに出ているイオウとの結合はポルフィリン環から出るのではなく鉄原子から出るように描くのが望ましい。また、このイオウ原子はペプチド鎖のシステイン残基に由来しているため、この表記にも少し工夫された方が望ましいだろう。さらに、反応の開始位置を明示しておいた方が親切だと思う。さらにさらに、中心の鉄原子はsp3d2混成軌道を持ち、正8面体の中央に位置していると考えて良さそうだ。以上述べたことを念頭に置いてこの図を読み解くと、下段にある”ferric”と書いてある分子に基質であるRHが結合するところから反応が始まる。(1)Substrate-bindingと描いてある図が、基質を取り込んだ状態である。この段階では基質は酵素に取り込まれただけで何の反応も起こしていない。
つぎに、酸素分子が鉄イオンに配位する形で結合する。その結果が (2) ferric-superoxide の図である。酸素が配意しても鉄の電荷が変化していないのは先の説明で了解出来る。同時に1個の電子が この反応時に取り込まれているため、酸素原子上にマイナスの電荷が発生している。納得、ここまでは何とか理解できる。この(2)にもう一つの電子が取り込まれて (3) ferric-peroxoと描いてあるイオンになる。この2個目の電子の在りかが分かりにくいが、過酸化水素から水素2原子がプロトンとして外れた残りの2価の酸素アニオンが3価の鉄に配位していると考えて良いのかな?そうして生成した2価のアニオンである (3) に2個のプロトンが順に結合した後、水が脱離して (5) ferryl-oxo-π-porphyrin cation radical (Compound I) が生成すると描いてあるのだが、ここはちょっと頂けない。2価の陰イオンにプロトンが2個反応しているので、その段階で電荷は消失しているはずである。ところが、Compound Iを見ると、鉄の電荷が+4になっただけでなく何処かに+イオンとラジカルがあることになっている。この部分の反応をちょっとだけ丁寧に書いてみると図13になると考える。
図13 水分子が脱離した後の鉄原子の原子価と酸素原子周りの電子配置
(4)にもう一つのプロトンが結合する。常識的に考えれば負電荷を持つ酸度原子に結合するのであろうが、次の脱水反応を考えるとオキソニウムイオンを作った方が分かり易い。このオキソニウムカチオンの酸素間の結合電子対が正に荷電した酸素上に移動すると、Compound Iとなるわけだが(慣れた人は、このイオンを作らずに酸素-酸素間の結合電子がプロトンを攻撃すると考えた方が、隣接する原子上にカチオンとアニオンを作るという変則的なことをせずに済むだろう)。その場合、結合した酸素原子上の電子は(B)あるいは左側の(C)、(D)または一番左の(A)どれかにしかならない。(A)の式における電荷をどう考えるかは、難問である。赤で示した電子対は酸素に属しており、鉄原子に供与されているとはいえ鉄の原子価には影響しない。Compound Iは他の2つの図においては5価の鉄と二重結合で結合している。鉄原子が5価になっているため、鉄原子上の2個の電子が鉄―酸素間の結合に移動させるしか方法はない。手品ではないが、突然鉄原子上に出現した電子対は、今まで描いていなかったものを描いただけである。そしてこの電子対を酸素との結合に使う訳だが、この2個の電子の帰属はどう扱えばいいのだろう。鉄に帰属させたら5価にはならない。共有電子として扱うと鉄はⅣ価になってしまう。安直に酸素に帰属させるのが最も簡単だが、その場合酸素周りの8電子が全て酸素に属することになり、酸素上にマイナス2の電荷を置かねばならない。それでも良いかと考えないでもないが、ここに描いてない次の反応が芳香環からの求核反応であることを考慮すると忸怩たるものがある。さらにだが、このCompound Iに対してはポルフィリン環窒素原子を関与させる考え方もある。(図14)
図14 ポルフィリン環の窒素原子を関与させる形で描いたCompound I
そして最後の段階、つまりferryl-oxo-π-porphyrin cation radicalと基質であるRHがようやく反応して、R-OHと元のferricと呼ばれているものに変えるのだが、この段階に関しては何も描いてない。酸素の活性化を描いてそれで終わりかという気分である。
もちろん、この図を描いた人にも言い分はあるだろう。1つは基質としているRHが広い範囲にわたっているため、どれを選ぶべきかで迷ってしまうというものである。もう一つは、この段階で起こっている反応をラジカル反応で描くかイオン反応で描くかについても迷っておられるのではないかと推察する。しかし、間違いである可能性があるにしても、それなりの反応メカニズムを提示されたらどうだろう。さらに反応に関与しない段階において基質分子(RH)をだらだらと書き続けるのは、どんな意味があるのだろう。基質(RH)が関与するのは(5)から(6)の段階のみである。
次は図11 についてである。再度図を示して議論を続けることにするが、議論しやすいように各中間体にナンバリングを行っている。
図11 Paquette SM, BakS, FeyereisenR.が提出しているP450の反応メカニズム
この図においてはポルフィリンの4つの窒素原子からなる正方形の中に鉄原子をおき、上下に配位子を描く形を取っており図10より幾分親切である。この図においては水分子が配位して鉄原子をカバーした I-Helix から反応を始めている。 I-Helix :Ⅰから水分子が外れると同時に基質であるSが酵素内のポケットにはまった形がⅡであろう。ここで1個の電子が鉄原子に供与されて、2化鉄への還元が起こりⅢを与える。疑問は、取り込んだ電子は鉄の原子価の変化として処理されたわけだが、Ⅲの分子全体としての電荷が変化していない点にある。錯体化学においては、取り込んだ電子に由来する電荷はどこに行ったのだろうと考えてはいけないようだ。
次の段階で酸素分子が結合する。つまりⅢに酸素分子が結合してⅣを与えるのだが、酸素分子状に電荷が発生していないところを見ると、酸素分子は配位子として結合したと考えざるを得ない。それは認めるとして、鉄原子が再び3価に戻っている。これは鉄原子から1個の電子が放出されていることを意味する。この電子は酸素に供与されたとしか考えられず、どちらかの酸素原子上に負電荷が発生していないと辻褄があわない。不可解である。さらに、Ⅳに対して外部から1個の電子が供給されてⅤが生成するのだが、どこに電荷があるのか分からない形で突然マイナス2の電荷を持たせて書かれている。電子1個を取り込んでマイナス2に変化するはずはないから、Ⅳの分子としてマイナス1の電荷があったと考える方が妥当であろう。
さらに、Ⅳ、Ⅴすなわちperoxoと書いてある式において2つの酸素間が2重結合になっているが、そう描いてしまうとオクテット則の縛りにより酸素原子上にマイナス電荷が存在できなくなってしまう。いや、ポルフィリン環の窒素原子をも含めて考えるべきと云われれば出来ないことはないのかもしれないが、次の段階でのプロトンとの結合が末端の酸素原子で起こっていることを考えれば、酸素酸素間の結合を単結合と描き、外側の酸素原子上に負電荷を置く方が考えやすいのではないか。そして、hydroperoxoと書いてあるⅥの式が得られるが、この式においても負電荷の位置は分からない。
電子論的立場からいえば鉄と結合した酸素原子上に置くのが妥当である。このⅥにもう一つのプロトンが結合したあと水分子が脱離してⅦつまりiron-oxoが生成するのだが、ここは結構難しい。外側にある酸素原子にプロトンが結合して生成したオキソニウムイオンが、酸素間にある結合電子をもって水分子として脱離する。それは分かる。その時点で3価の鉄に結合する酸素原子には2つの孤立電子対(Fundの規則に従えば、1つの孤立電子対と並行スピンを持つ2個の電子かもしれない)と鉄に供与している孤立電子対が存在し、電荷は0となる。Iron-oxoと表記している式においては、鉄が5価になっている。鉄が5価になるためには2個の電子を放出する必要がある。
どうやら、鉄原子上に存在する電子対を酸素との結合に使っているようだ。そうするとこの2個の電子の帰属についての判断が難しい。鉄は5価になっているので、鉄に所属させるわけにはいかない。酸素に所属しているとすれば、酸素の電荷がマイナス2となってしまう。これでは次の反応を考えるときに幾分以上に都合が悪いのだが、どうやらそういうことは見せない形で話を進めることになっているらしい。但し、この鉄(Ⅴ)-オキソ錯体が存在しているという証明はまだないようだ。
そして、この鉄(Ⅴ)-オキソ錯体が最初に結合していた基質分子に水酸基を導入することになるのだが、図 10 の場合と同じく生産物が描いてあるだけで途中は見事に抜けている。批難ではない。分かっていないところがあることは理解するが、説明されているのは酸素分子の活性化の部分だけではないか。「羊頭狗肉」ではなく「羊頭無肉」である。水酸化酵素の反応メカニズムとして描くのであれば、水酸基が生成する部分のメカニズムを描いて欲しいと思うのは望みすぎだろうか。
次は図12についてである。
図12 英語版Wikipediaに載っているP450の触媒サイクル
この図においては3価の鉄錯体に水分子が配位している状態から反応が開始される。この水分子のふたが外れながら、基質であるRHが酵素と結合する。次に1個の電子が鉄原子に供給され2価の鉄錯体となる。ここで、先に述べた疑問がまた起こる。取り込まれた1個の電子の電荷はどこに行ったのか。鉄の原子価が減っているので荷電は描かなくてよいのだろうか。次の③の反応で酸素の導入が起こるのだが、この図では酸素-酸素間の結合が単結合で描いてあり、 図10と同じであるが、図11とは一致しない。私も図11がおかしいと思う。だがしかし、生起した3価の鉄酸素錯体の電子構造には合意できない。2つの酸素間が単結合であれば、bi-radical構造の酸素分子と同じ電子構造と考えてよいだろう。外側の酸素がラジカルとして描いてあるのは認めるが、そうであれば鉄に配位している酸素原子上にも不対電子がなければならないのだがそうはなっていない。きっと、2価の鉄が3価の鉄に戻る際に1電子をこの酸素に与えたという判断だろう。しかし、そうしたのであればこの酸素原子は再外殻に7個の電子を持つことになり、マイナス1の電荷を持たねばならない。次にもう一つの電子が供給されて外側の酸素上にもマイナス1の電荷が発生した後、2個のプロトンがが反応に参加し水が脱離する。陽イオン2つが取り込まれて中性の分子が脱離したのであるから、本体の電荷は2増加するはずである。図 12によれば、前段階でマイナス1の電荷を持っているので、生成した5価の鉄錯体はプラス1の電荷を持つはずであるが、どうも持っていないようだ。そこから先は一瀉千里、何の説明もなくROHができ水分子のふたがされている。
P450は水酸化酵素を意味する。基質の一方が酸素であることは認めるが、今一つの基質をここまで軽視することは片手落ちではないか。(片手落ちという言葉は差別用語だと憤る方々がいるそうだが、中道で保守的で日本語を大事にする人間として「片手のない人を片手落ちとは云わない」、「バランスの取れない」ことを意味する用語として使われてきた伝統と歴史を重んじて、ここで使用する。)
厳しく書いているように思えるだろうが、この批判の矛先は私自身に向く危険なものである。「先に書いたアブシジン酸の総合的理解のために」というブログの中で、Oxygenative Burst 仮説を提案した。そこにおいて、Oxygenaseの本来の基質は酸素であり、酸化される基質は酸素と反応するものであれば何でも良い。酸素を消費することがOxygenaseの最も重要な存在意義であると述べた。そうであれば、私は酸素の活性化部分を詳しく述べた上記のサイト群の描き方を認めるべきであり、批判は控えめにすべきかもしれない。だが、よく考えてみるとこの議論は痛み分けに終わるようだ。世の中の多くの研究者は、酸素は横に置いて酸化される物質群の多様さを語り、この反応に関与する物質群の生理活性を基礎にした議論を行っている。上記のサイトの著者グループがどのような立ち位置にいるかは別にして、この酸化反応に関与する物質群には全く触れずに酸素の活性化だけで満足しているとすれば、これもまた、はなはだ奇妙である。
などと書き連ねたにしても、役に立たない暇人の戯言として受け取られるかもしれない。口さがない友人であれば、「文句を言う暇があればお前が描け」と云うに違いない。されどである、私は錯体化学には造詣が深くない。いや、極めて浅い。従って、上の批判では鉄原子の電子配置にはほとんど触れていない。鉄や外側から出入りした電子を、酸素原子上で矛盾なく配置するにはどう考えればよいかという観点からの批判に過ぎない。ひょっとしたら的外れであるかもしれないとさえ思っている。
しかし、身元を明らかにせずに一方的に批判したのは、確かにフェアーではない。ここは、無知を晒す覚悟の上で、自らの意見を議論の敲き台として提示するしかないだろう。何度も言うようだが、鉄原子の電子配置にはほとんど触らない形での図として受け取って欲しい。図15にその敲き台を示す。
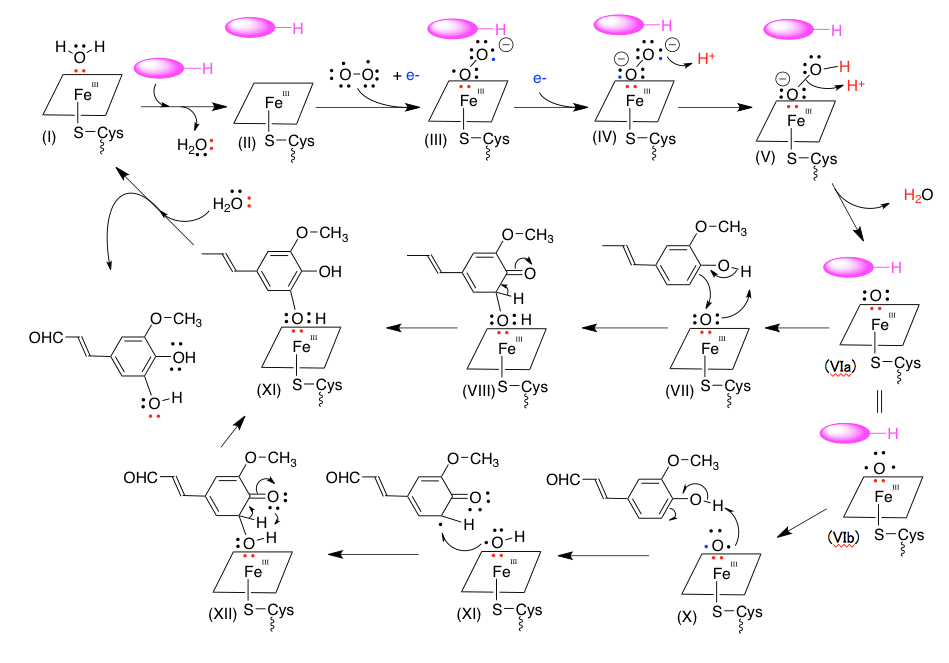
図15 P450における酸素活性化機構と水酸化機構の敲き台
中央の鉄原子は錯体の形からしてd2sp3タイプの軌道を持つと考えてよいだろう。そうすると、平面の正方形の4隅にポルフィリンのの窒素原子が存在し、上下に残り2つの結合があることになる。その片方は酵素のシステイン残基に由来するSH基との反応で作られたスルフィド結合であり、もう一つの部分で酸素の活性化に続く基質の水酸化が起こることになる。これを絵にするためには、4つの窒素原子からなる正方形で鉄原子を囲み、上または下へシステインとの結合を出すのが妥当だと考え、図4-12類似の表記を採用することとした。但し、窒素と鉄の結合を線にして描くと鬱陶しいため、これは省略している。赤く示した電子対は酸素から鉄原子へ配位した電子対をしめしている。酸素-鉄間に結合は出来ているが、電子の所属は酸素側であることを意味している。
そのように描いたⅠを出発物質とする。Ⅰから水分子が脱離すると同時に基質が活性部位に取り込まれたものをⅡで現す。このⅡに酸素分子が結合するのだが、その後の酸素―酸素結合を単結合で処理したいので、バイラジカル構造の酸素分子を鉄原子に配位させることにした。この時同時に取り込まれる電子は、外側の酸素状に移動し、この酸素にマイナス1の電荷が乗ることになる。(鉄原子の隣の酸素に載せてもよい。次の反応で同じことになる)この後、外部から1電子が隣の酸素原子に動きこの酸素原子もマイナス1の電荷を持つように記載する。最初に取り込まれる電子を鉄原子上に移して鉄原子の原子価をIIも変えても良いのだが、ここは理研のサイトの描き方を真似させてもらうことにした。鉄の原子価で電子を処理すると、電荷の扱いが見えにくくなるのが理由である。
この後、2個のプロトンが反応に参加した後の水が脱離するのだが、IVの外側の酸素にプロトンが結合した後、vに示すようにもう一個のプロトンに対し酸素―酸素結合に関与していた電子対が攻撃をして水分子が生成するように描いてみた。この時点でVIの分子全体としての電荷はゼロとなる。このVIの電子構造については、図13で議論したように、いくつかの状態が考えられるだろう。
ここからは、基質がコニフェリルアルデヒドであるとして、水酸化のメカニズムを推測した。VIに対して2つの電子状態を考えた。上段のVIはL殻に6個の電子を持っているため電荷は持たない。このような状態の酸素が、ナイトレンやカルベンのようにコニフェリルアルデヒドから電子対を受け入れてオクテット状態になった後、再度芳香化することで5-ヒドロキシコニフェリルアルデヒドが鉄原子に配位したXIをあたえる可能性を考えた。XIに対して水がSNi型の反応を行い5-ヒドロキシコニフェリルアルデヒドを追い出しながら、Iに戻るというわけである。
通常、芳香環上で起こる反応は求電子置換反応であり、反応するリガンドは正に荷電している。時に、求核置換反応も起こらないではないが、その場合は芳香環上に強い電子吸引性を持つ置換基が存在する。この場合は基質であるコニフェリルアルデヒドにはそのような置換基は存在しないだけではなく、強い電子供与性を持つ水酸基とメトキシ基があるため、求電子置換型の反応は考えにくい。従って、酸素原子上にマイナス電荷を持たせない形を考えるべきだろう。そういう意味では図14の5価の鉄錯体は考えにくい。この式においては、酸素はマイナス2の電荷を持つからである。ただ、VIaとして描いた酸素の電子構造が存在するかどうか、存在する場合でもどれくらいの時間存在するかについての知識は全くない。
もう一つの推定可能な経路は、VIbを経由する反応である。酸素1原子でバイラジカルとこれも考えにくい構造だが、このラジカルがコニフェリルアルコールのフェノール性水酸基の水素原子をラジカルとして攻撃する。すると、リグニン生合成の最後の段階と同じだが、1電子移動が起こって水酸基のα位にラジカルが出現する。このラジカルが酸素原子に残ったもう一つのラジカルと結合するとXIIが生成する。XIIはエノール化を伴う芳香化を起こして、5-ヒドロキシコニフェリルアルデヒドが鉄原子に配位したXIとなり、先に述べた水との反応で出発物質であるIと生成物である5-ヒドロキシコニフェリルアルデヒドが得られることになる。(この図の中で、プロトンの処理は化学量論的な意味合いで描いているので、外れたプロトンが必ずしも隣に移動するわけではない。)
最初の経路においては、酸素原子がオクテット構造になると安定化するという性質をドライビングフォースとして考えたもの、次の経路は不対電子の反応性の高さをドライビングフォースとして考えたものである。量子化学に造詣の深い方がおられれば、ViaとVIbについてそれらの安定性、言い換えれば反応性を求めることができると思う。その結果、これらの経路が有り得ないということになっても、私としては考える楽しみがまだ残るということになる。
まあここまでで、芳香環の水酸化の問題は一応終わったわけだ。とはいえ、本当に終わったわけではなく、いくつもの問題が残っている。私の敲き台が本当であるかどうかも分からない。NADPHに由来するであろう流入する電子の起源も押さえなければならない。疑問はまだ山積している。だが、そうした疑問を考える以上に、この辺りの分野には余り詳しくないにもかかわらず首を突っ込みすぎてしまったと、かなり、いやとても反省している。これ以上拘泥してもいいアイデアは浮かばないだろう。今少し錯体化学関連の本を読み、考える必要を感じている。取り敢えず、気分転換を兼ねて先に進もう。
さて、生成した水酸基のメチル化はS-アデノシルメチオニンをメチル基の供与体として起こる反応で、1 carbon unit metabolismとして記述される葉酸を介して起こる代謝と共役した代謝であると考えて良い。Folic acid (葉酸)は、極めて重要な代謝を担っているにもかかわらず、栄養学的な見地からビタミンとして講義される場合が多い。その際、きちんと反応を追った講義はなされず、不足すると核酸の生合成がうまく進みませんよ、貧血を起こしますよ、などというような栄養学的あるいは医学的説明に終わる場合が多いようだ。ちょっとだけ寄り道になるが、葉酸の関連する代謝について述べてみよう。まず葉酸は何をしているのかという問題だが、葉酸と入れてグーグル検索をかけると、残念なことに1位から30位までの中でWikipediaの葉酸の項が1つ引っかかるだけで、残りは全て栄養学的な観点からのサイトで、かつそのほとんど全てがサプリメントの釣り広告である。
Web空間の質の低下が顕著に表れた例の1つである。近頃はグーグルスコアラーを使うことが多いのだが、グーグルスコアラーで検索しても葉酸とは本来何であるかという観点からの記事にはなかなか出会わない。これでは、専門家以外の人々の理解程度が落ちてしまう。若い向学心溢れる学生達のために、ちょっとだけレベルを上げた解説をしておこう。葉酸を中心に考えるといった場合、2つの代謝系が思い浮かぶ。1つは葉酸そのものの生合成系であり、もう一つは葉酸の存在によって動く代謝系である。2つの系ともに、結構面白い。
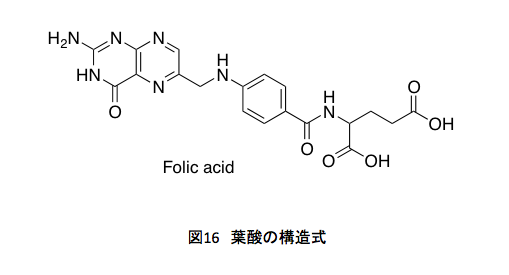
まず葉酸生合成系についてだが、その前に葉酸の構造式(図16)を示しておく。
葉酸は、我々が生きていく上で欠かすことのできない物質(ビタミン)である。だが、黙ってこの構造式を見せ、「この化合物を少し食べんね」と話を振ると、まず全ての人がぶるぶると首を振ってこんなものは食べたくないという。自然食を賛美している人ほどそうである。シアノコバラミンを見せるともっと首を振る。それはそうと、この葉酸は3つの部分に分けて考えることができる。左側のプテリン部分、中央にあるパラアミノ安息香酸部分、そして右側のグルタミン酸部分である。
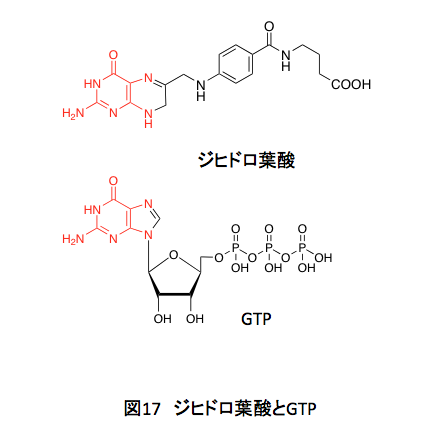
右側のグルタミン酸部分はアミノ酸のグルタミン酸に由来する。これはいうまでもない。中央にあるパラアミノ安息香酸、これはシキミ酸系から誘導される化合物で、コリスミ酸から4-アミノ-4-デオキシコリスミ酸を通ってパラアミノ安息香酸が生合成される。この部分は、コリスミ酸の4位にどのようにアミノ基が導入されるのかが鍵となるだろう。左側にプテリジン部分はどのように生合成されるのか。それは図17を見ればすぐに推測できそうだ。赤く示している部分の共通性を見れば、核酸塩基であるグアニジンに由来するだろうことは容易に想像できるだろう。
ところが、実際の経路はかなりトリッキーでトレースしてみると非常に面白い。葉酸の生合成については、生体内で高エネルギー物質として知られているグアノシン-3-リン酸から描くことにする。GTPの生合成も面白いのだが、そこまで戻ると話が長くなりすぎるし、戻らねばならない必然性がないからである。
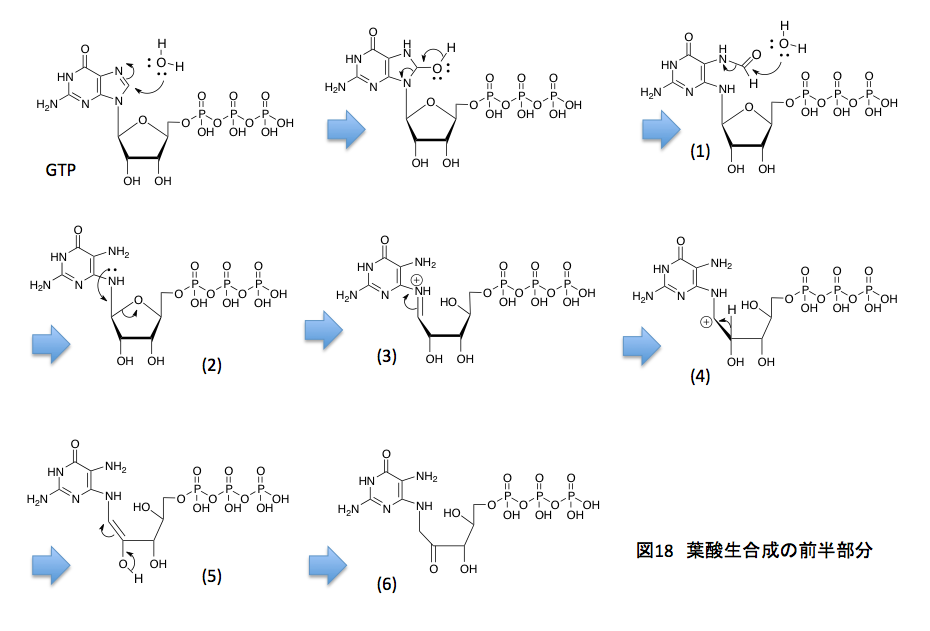
上の図18に示すように、まず、グアニン環を構成しているイミダゾール部分が加水分解を受け、N-ホルミル体(1)ができる。このN-ホルミル体はアミノ基とギ酸との間で形成されたアミドであるため、これがさらに加水分解を受け、アミノ基が露出した化合物(2)、IUPACで命名すれば ((2S, 3R, 4S, 5S)-5-((2,5-diamino-6-oxo-1,6-dihydropyrimidin-4-yl)amino)-3,4-dihydroxytetrahydrofuran-2-yl)methyl tetrahydrogen triphosphateとなるのかな、に変換される。ここまで来ると命名法自体が最早魔法のようなもので、名付けた本人も正しいかどうか判らないほどだ。
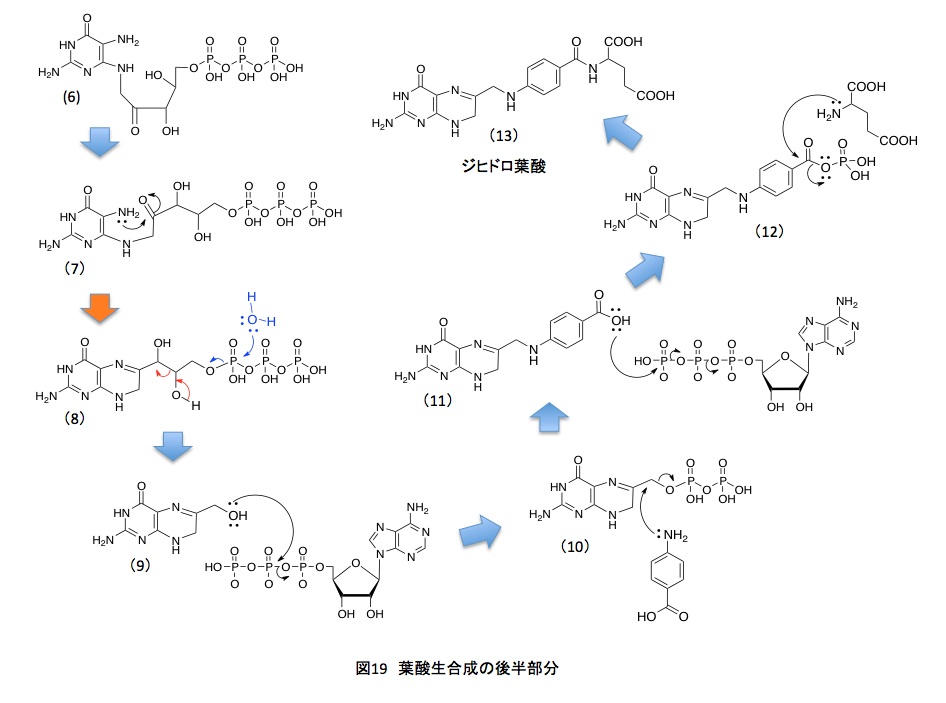
ここからは窒素原子に特有ともいえる反応だが、まず窒素原子上にある孤立電子対をリボースの5位の炭素との結合に与えると同時にアセタール型のC-O結合が切れてシッフの塩基(3)が出現する。(3)においては窒素原子上に正電荷があるため、C原子とN原子 間のπ結合している電子対が窒素原子に戻り、窒素原子の α 位の炭素上に正電荷を持つ中間体(4)を生じる。ここで β 位の炭素上に存在する水素原子がプロトンとして脱離し(5)を与えるのだが、(5)はエノールと呼ばれるカテゴリーに含まれる化合物で容易にケト型へと異性化して、(6)となる。もう少しズームアウトした観点から見れば、グアニン9位の窒素についたリボースがリブロースに変わったと考えればよい。(2)から(6)にかけてのアルドースがケトースに変換される反応をアマドリ転移といい、この転移反応はトリプトファンの生合成においても重要な役を果たしている反応である。この段階でプテリンの7位の炭素の用意が終わったことになる。続く反応を図19に示すことにする。
(6)と(7)は同一化合物である。描き方をちょっと変えて反応する部分を近付けたに過ぎない。私がまだ未熟だった頃、頭の中で立体的構造をうまく組み立てきれずに、何でこんなところが反応するんだよと叫んでいたことを記憶している。組み立て式分子模型の時代が終わり、今ではディスプレイ上で色々な形を試せるようになっているため、転移反応の理解はしやすくなっていると思うのだが、体を動かして納得した知識の方が頭に残るような気もしている。(7)においては、ちょうど良い位置にアミノ基とカルボニル基があることを示している。両者が脱水を伴いシッフの塩基を形成すると(8)の化合物が得られるが、この段階でプテリン骨格が完成したことになる。5員環であるイミダゾール環に1炭素を増やして6員環のピラジン環にするために、ここまでの反応を必要としたわけである。これから先は、側鎖部分を作ればよい。
そうはいっても葉酸における6位の炭素鎖は1個であるのに、(8)の化合物は3炭素の側鎖を持つ。従って、ここで2炭素ユニットを捨てなければならない。うまくできたもので、まず3個からなるリン酸残基が捨てられる。高エネルギー物質であるため、ちょっともったいない気がするがそれは仕方がない。加水分解で青い矢印で示したようにトリリン酸を捨てた後、1, 2-ジオールの部分でアルドール縮合の逆反応、即ちレトロアルドール縮合が起こる。(赤で示した矢印)その結果、グリコールアルデヒドが捨てられて6位にヒドロキシメチル基を持つ(9)が生成する。このヒドロキシメチル基の水酸基がATPと反応してピロリン酸エステルとなり脱離性が向上した時点で、4-アミノ安息香酸のアミノ基が求核的に置換反応を起すと(11)のカルボン酸が生成する。このカルボン酸もまたATPと反応して、混合酸無水物へと活性化された後、グルタミン酸のアミノ基とペプチド結合を形成して、ジヒドロ葉酸(13)となり、ここで葉酸の生合成系が完成する。GTPから始まったこの経路では、GTPの3-リン酸部分を捨て、次の段階でATPに由来するピロリン酸を捨て、最後に再度、ATPに由来するリン酸を捨てている。そうまでして作られる葉酸は、きっととても重要なモノであるに違いない。
さて、先に示した葉酸生合成の中で、ジヒドロ葉酸で反応を止めた。何故葉酸まで記述しないのかと不審に思った方もいるだろう。確かに、ジヒドロ葉酸から葉酸に至る経路はあるのだが、どうも葉酸は貯蔵プール的な位置にあるらしい。葉酸が関与する代謝はジヒドロ葉酸とテトラヒドロ葉酸を軸として動いており、葉酸そのものが貯蔵物質としての意味を持たないとすれば、葉酸の出る幕はない。とはいえ、相互変換するこの葉酸、ジヒドロ葉酸、テトラヒドロ葉酸が生体内で果たす役割は重要である。役割が重要であるから、ほぼ全ての植物はその生合成系を持っている。真正細菌も古細菌も持っているようだ。従って、彼らにとって葉酸はビタミンではない。この生合成系を欠く動物にとってのみ葉酸はビタミンであるわけだ。
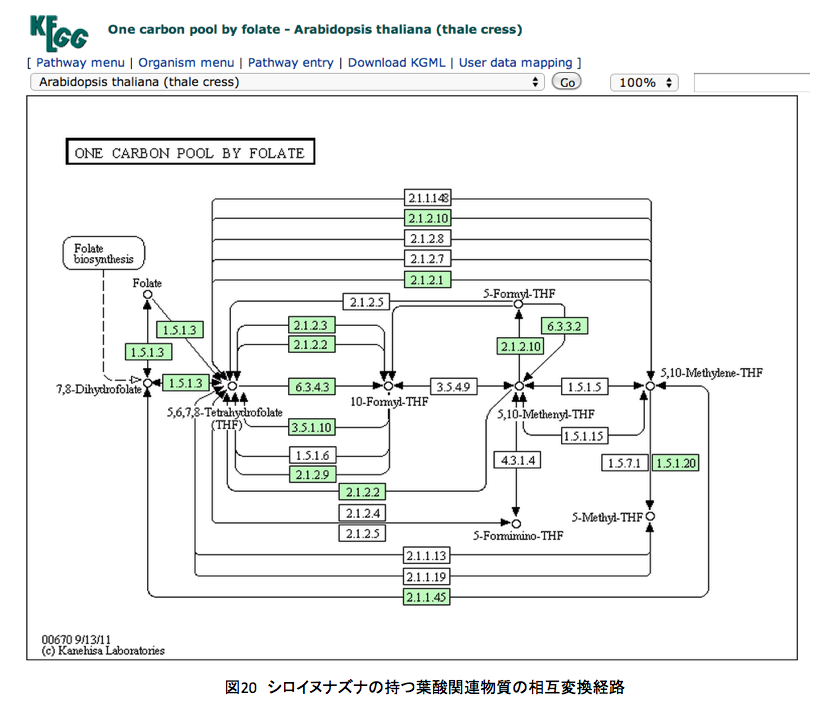
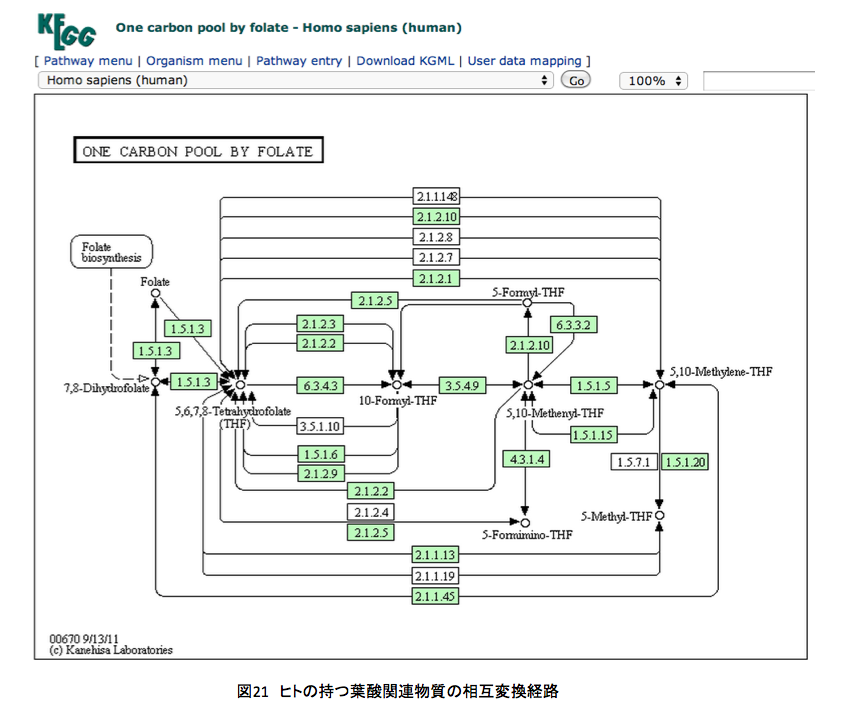
図20と図21にシロイヌナズナおよびヒトの持つ葉酸関連物質の相互変換経路を示している。例のごとくKEGGからの引用である。
左上にあるFolate(葉酸)が複雑な系の外側にあるのが見て取れる。重要な反応は中段の7,8-Dihydrofolate, 5, 6, 7, 8-Tetrahydrofolate, 10-Formyl-THF ( 左上にあるFolate(葉酸)が複雑な系の外側にあるのが見て取れる。重要な反応は中段の7,8-Dihydrofolate, 5, 6, 7, 8-Tetrahydrofolate, 10-Formyl-THF (10-Formyl-tetrahydrofolate), 5, 10,-Methenyl-THF (5, 10,-Methenyl-tetrahydrofolate), 5, 10,-Methylene-THF (5, 10,-Methylene-tetrahydrofolate)、あるいはその上下にある5-Formyl-THF (5-Formyl-tetrahydrofolate), 5-Formimino-THF (5-Formimino-tetrahydrofolate) の間で起こっている。
ヒトはジヒドロ葉酸までの生合成系は持たないくせに、その後の代謝系は極めて充実しているようだ。さらに、テトラヒドロ葉酸と10-ホルミル葉酸の間をつなぐ代謝系路の多さには驚くしかない。よほど重要な意義があるに違いない。このあたりの代謝はとても興味深いのだが、あまりに葉酸代謝に拘泥しすぎると、本来のリグニンの話を忘れてしまう。取り急ぎ、図22を眺めながら余り煩雑にならない程度の説明を加えることにする。
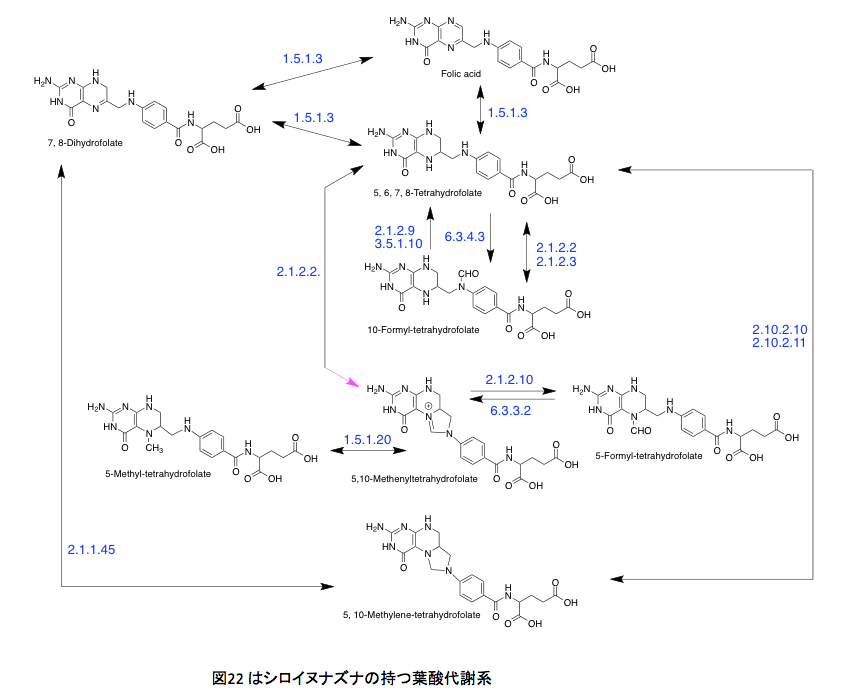
図22 はシロイヌナズナの持つ葉酸代謝系である。矢印の横に示した青い数字はECナンバーである。まずEC1.5.1.3だが、これはNADあるいはNADPを補酵素として起こる葉酸の酸化還元反応であり、特にコメントすることはない。EC1.5.1.20も同じである。丹念に代謝を追っていただければ、なんということはない。1炭素ユニットを葉酸が取り込み、その炭素部分を幾分修飾して次の反応でこれを放出する。それだけの話に過ぎない。しかしながら、単にその議論で次に進んでいいかといえば、そういうわけにも行くまい。その1炭素の行き先が非常に重要だからである。EC 2.1.2.2 とEC 2.1.2.3 はphosphoribosylglycinamide のアミド部分のホルミル化を起こす酵素で一見何をしているか分かりにくいが、この代謝の下流にはIMP、GMP、AMPなどプリン環を持つ核酸塩基が存在する。(図23)要するに生物現象におけるエネルギーを供給するATP、GTP、ITPなど物質的基盤を担っている代謝系でありリグニンのみに限定されるようなものではない。さらにウラシルからチミン生合成にも関与している。この系がなければDNA生合成が動かないだけでなく、エネルギー代謝系が機能せず指一本動かなくなるわけだ。さらに別の側面もある。EC 6.3.4.3とEC3.5.1.10はギ酸代謝酵素と考えても良いかもしれない。ギ酸の炭素原子をテトラヒドロ葉酸の10位にトラップして、これを1炭素源として使用する最初の段階と考えて良い。
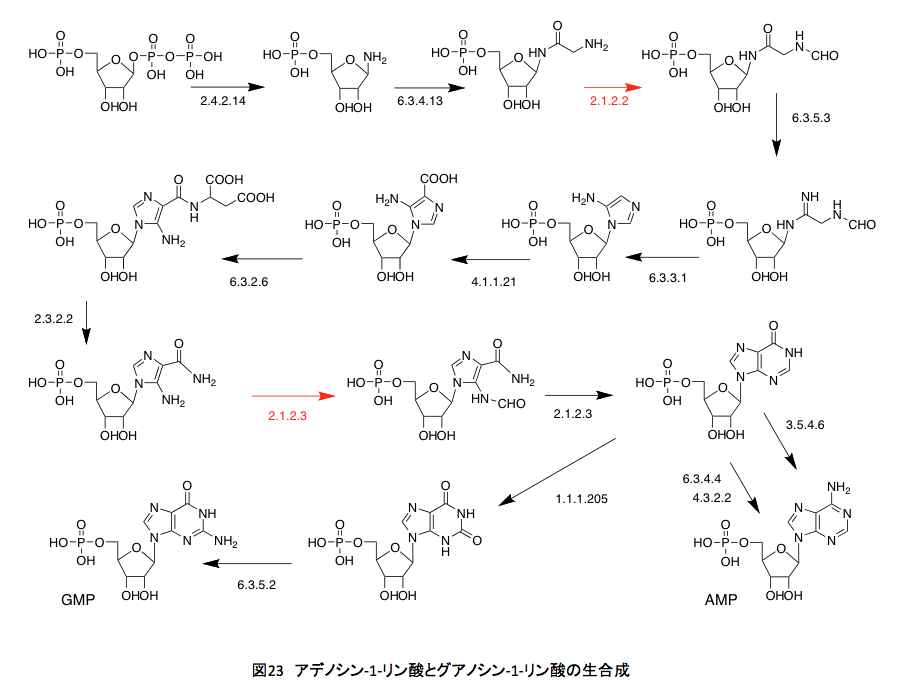
さらにさらに、図22のEC 2.1.2.9は授業においてはあまり言及されることはない酵素であるが、この酵素の存在意義は生化学を少しでもかじった者であれば必ず知っている。名前はmethionyl-tRNA formyltransferase、メチオニンを運ぶアミノアシルtRNAのメチオニン残基にあるアミノ基をホルミル化する酵素である。バクテリアとバクテリアに由来する真核生物の細胞小器官(ミトコンドリア、葉緑体)においては、翻訳段階で開始コドンとして働くAUGに対応するアミノアシルN-ホルミルメチオニンを生合成する酵素である。
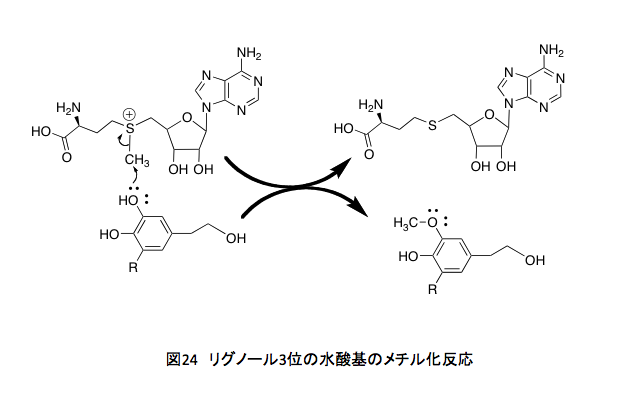
何を書いているのだ、まるで高田崇史氏の書く蘊蓄小説ではないか(これは高田崇史氏への批判ではない。応援である。氏の著素に関してはその殆どを購入して読んだ。QEDシリーズのように鮮やかな終幕が書ければいいのだが)と言われそうだが、じつはリグニンのメチル化された水酸基の由来の話をしているのである。前半に書いたP450は、現在はCYP (Cytochrome P450) と表され場合が多くなったが、この酵素による芳香環への水酸基の導入部分の説明にあたる。CYPの藩王メカニズムに続く後半部分は、導入された水酸基のメチル化において、そのメチル基すなわち生体内における1炭素代謝をつかさどっている葉酸についての説明である。とはいえその葉酸の代謝と水酸基のメチル化がどう繋がっているかは少々見えにくい。その部分について少しだけ補っておこう。 リグノールの3位の水酸基のメチル化はさほど問題ではない。フェノール性の水酸基が、S-アデノシルメチオニンの正に荷電した硫黄原子についたメチル基を求核的に攻撃してメチル化物とS-アデノシルホモシステインを与える反応で物珍しくも何ともない。(図24)
問題はS-アデノシルメチオニンのメチル基がどこから来たのかという点にある。他に疑問があるとすれば、どうして4位の水酸基は反応しないのかという事くらいであろう。その答えは、ここで働くメチル化酵素の活性部位の形が原因でしょうというほかにない。4位の水酸基をメチル化する酵素も進化の過程でできたかもしれないと思う。だが、4位の水酸基がメチル基でブロックされると、次の段階の酸化的ラジカル反応が起こらなくなる。それは、植物にとって由々しき自体を引き起こすことを意味するのである。それ故に4位の水酸基をメチル化する酵素は、進化の過程で淘汰されていったに違いない。由々しき事態の詳細は後述することにする。
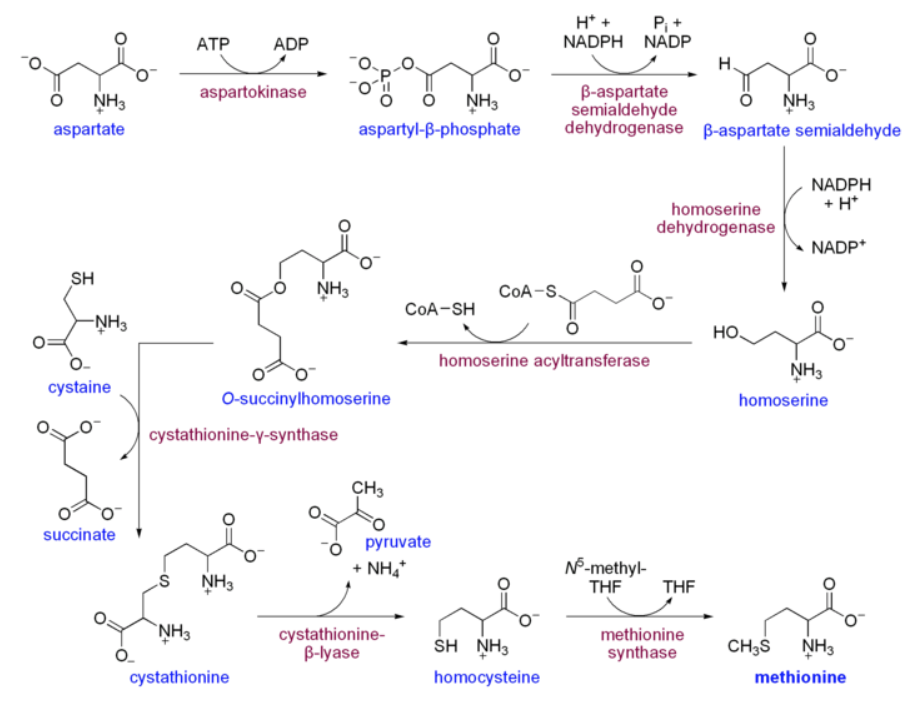
さて問題となるメチル基の起源だが、このメチル基はメチオニンに由来する。それは当たり前だと思われるかもしれないが、ではメチオニンの硫黄原子についたメチル基はどうやって作られるのか。ヒトにとっては、メチオニンは必須アミノ酸であり食事から取り入れているので関係ないというわけには行くまい。食べるメチオニンはどう作られるのか。図を描くのが疲れてきた。ここはウィキペディアからの引用で済ませることにする。
図25 メチオニンの生合成系 Wikipedia メチオニンのページより引用
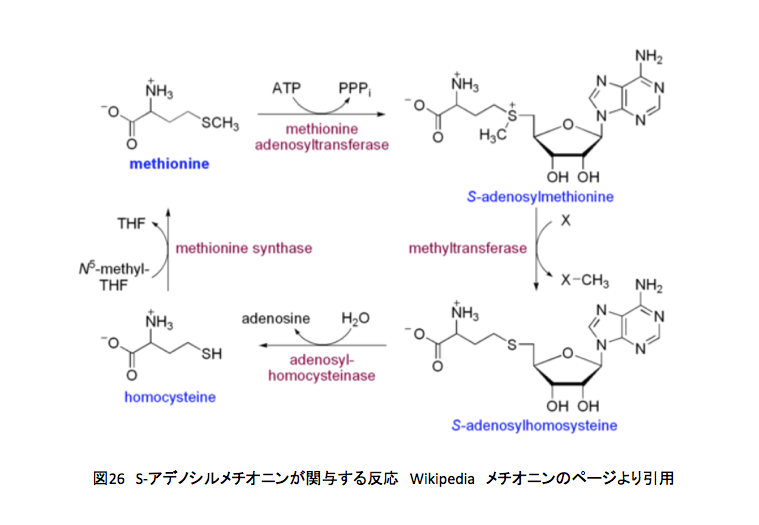
上記の反応系の最後の反応、ホモシステインからメチオニンへの段階がN5-メチルテトラヒドロ葉酸からのメチル基転移である。メチオニンは用意が出来た、次はどうなるのかを図26に示そう。
メチオニンはメチオニンアデノシル転移酵素による触媒下にATPと反応してS-アデノシルメチオニンとなる。このS-アデノシルメチオニンのメチル基が他の分子にメチル基を供与しS-アデノシルホモシステインとなった後、再びホモシステインを通ってメチオニンに戻る事になる。ホモシステインからメチオニンへの変換反応がテトラヒドロ葉酸の関与する反応である。また、S-アデノシルメチオニンからS-アデノシルホモシステインへの反応におけるXがメチル化を受ける物質、リグニン生合成系においてはリグノール類に相当するわけだ。
あちこち引っかき回して記憶の欠片を拾い集め、ようやくここまできた。あと少しである。蘊蓄ばかりで面白くないと感じる人々には気の毒だが、もうちょっと続ける事にする。
因に、記憶とは神経細胞に残った時の欠片かもしれない。完全には重ならないにしろ記憶を追憶と言いかえれば、私の好きな文章がある。数年前に亡くなった北杜夫氏が書いた初めての小説「幽霊」の書き出しである。
「人はなぜ追憶を語るのだろうか。どの民族にも神話があるように、どの個人にも心の神話があるものだ。その神話は次第にうすれ、やがて時間の深みのなかに姿を失うかに見える。だが、あのおぼろな昔に人の心にしのびこみ、そっと爪跡を残していった事柄を、人は知らず知らず、くる年もくる年も反芻しつづけているものらしい。 それにしても、人はそんな反芻をまったく無意識につづけながら、なぜかふっと目ざめることがある。わけもなく桑の葉に穴をあけている蚕が、自分の咀嚼するかすかな音に気づいて、不安げに首をもたげるようなものだ。そんなとき、蚕はどんな気持がするのだろうか。」
こんな叙情的な文章が書ければ、私もやくざな科学者などはしていなかったかもしれない。カイコはきっと懐古するんだろうねなどと茶化しているようでは作家にはなれない。どこかプルースト的発想を匂わせるこの文章にシンパシーを感じる理由は、ある種の色や匂いに伴って思い出される記憶があるという実感にあるのだろう。ただ、その記憶がかなり即物的であるということが、文学者ではないという証かもしれない。
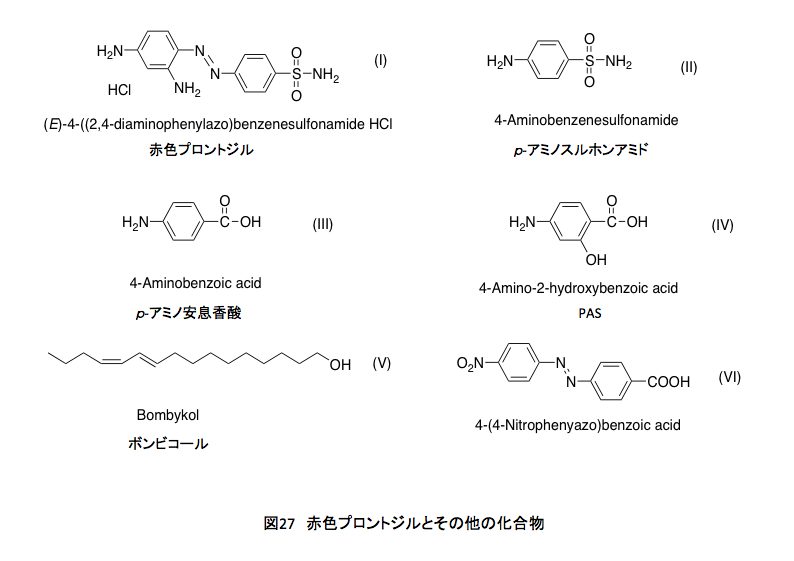
理由は分からない。赤い溶液を見ると、すぐに赤色プロントジルを思い出す。薬物として、作用メカニズムを初めて理解したのがこの化合物であった。この化合物は図27に示す Ⅰ: 4-(2,4-ジアミノフェニル)ベンゼンスルフォンアミドの構造を持つ、人類が初めて手にした化学療法剤である。発見者がドイツ人のゲルハルト・ドーマクであるとか、連鎖球菌に感染した自分の娘に与えて治療したなどという話はネットの世界に任せるとして、この化合物は投与された後、体内で還元的にアゾ基の解裂を起し、Ⅱ: p -アミノスルフォンアミドとなって作用を示す。その後、いわゆるサルファ剤と呼ばれる合成抗菌薬の端緒となった化合物である。
p -アミノスルフォンアミドは葉酸の成分であるⅢ: p -アミノ安息香酸とよく似た形と電荷分布を持つため、葉酸の生合成において、p -アミノ安息香酸の替わりに酵素の活性部位に入り込み、葉酸生合成反応を止めてしまう。そうすると感染している細菌は増殖できないが、これをビタミンとして外部に依存している哺乳類は大きな影響を受けないという訳である。ふふ、ようやく葉酸とつながった。恥ずかしながら、結核治療薬であるパスを、長い間 Ⅱのことだと思い込んでいた。実は数年前に間違いに気付き、記憶し直したはずだったのだが、記憶しなおしたことを再度忘れていた。パスはⅣ: 4-Animosalycilic acid(4-アミノサリチル酸)であり、この化合物もまた葉酸生合成を阻害する。また忘れるかもしれないな。
修士課程に在学中の話だが、ある種のカビの抽出物中で水酸基を持っているらしい物質の分離で苦しんでいた。材料は極めて少ししかなかった。腕が悪かったのも一因だが、カラムクロマトあるいは手作りの薄層プレートでの分離を数回繰り返すと、紫外吸光スペクトルがとれる程度の量しか残らない。そんな折りに、ブテナントのボンビコール単離の報告を読んだ。そこには、カイコの性ホルモンであるⅤ: ボンビコールをアゾ基を発色団として持つⅥ: 4-(4-Nitrophenyazo)benzoic acidとのエステルに変えて可視化し、カラムクロマトによる分離をしたと書いてあった。
早速 Ⅵ を合成し、チオニルクロライドで酸塩化物にして抽出物と反応を行った。赤く着色した単一の成分を分離した。これこそ本当のクロマトグラフィーだなどと喜んだのだが、加水分解してVI 部分を除き元に戻そうとしたら、大事な本体も加水分解されたらしく、Ⅵだけが空しく残っていた。加水分解前に質量分析を行い、分子量が多分407、そうであれば目的物の分子量は154になると推定はしたのだが、親ピークの余りの小ささ故に確信は持てなかった。IRとUVの結果を加味して、可能性のある構造を3つか4つ描いて修士論文とした記憶が残っている。そのうちの1つが正しかったのでまあ良しとしよう。この時に合成した赤色のカルボン酸4-(4-Nitrophenyazo)benzoic acidの結晶の色は、赤色プロントジルの色によく似ていた。赤色溶液から赤色プロントジルへの連想は、どうもこの時の記憶が定着したらしい。追憶とは言い難いな。
さて、大学では有機化学も教えていた。試験では点数を与えるための問題を用意する。そうしないと大変な結果を招くからだ。次の官能基の名前を書け。そして次のような官能基を示すわけだ。
(-OH, -NH2, -CH3, -C=O, -N=N-)
勿論、真面目な学生にとってはあほくさい問題であるが、これで躓く学生も一定数いた。採点をしていると、?と感じる答案が複数枚ある。アミノ基がマミノ基となっている。カルボニル基がカルボール基になっている、アゾ基がマゾ基になっている。これは何だと考え込んだのだが、試験における彼らの席順を見て原因が分かった。良くできるとはいえないまでも真面目な学生を前に置いて、順に盗み見した結果である。ヒトの書く字には癖がある。前に座った学生は、カタカナのニの上の線を小さく書くだけでなく、アとマの区別がつきにくい学生だった。後ろから見た学生は、マミノ基、カルボール基、マゾ基と書いた。それに連なる数人の学生は皆、これをまねた。マミノ基については途中で復帰変異が起こりアミノ基に戻っていた。しかし、夜中に採点しているとき、マゾ基、マゾ基と続くのは不思議な気分である。アゾ基の記憶つながりで思い出す、古き良き時代の話である。
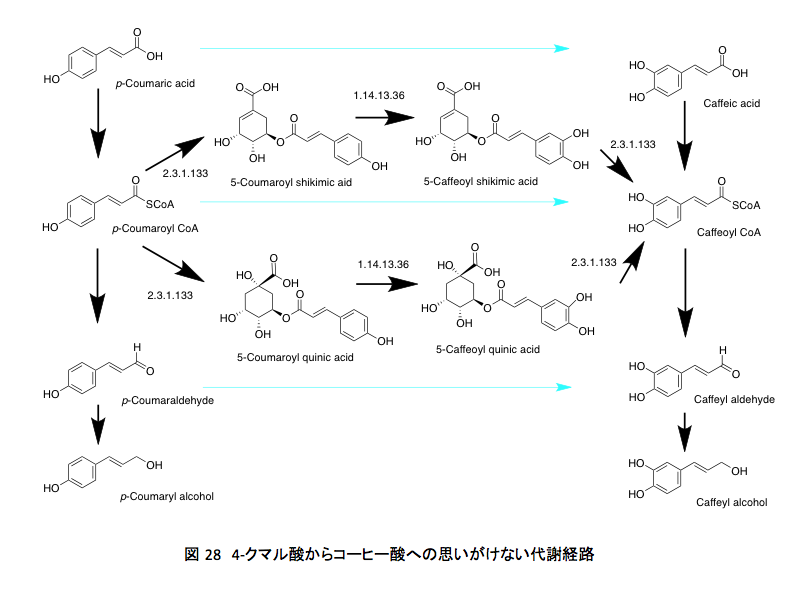
西暦2,000年頃、在籍していた大学では定員割れが顕在化していたため、私は学科改組、カリキュラムの改悪、進級制度の改悪、修士課程、博士課程の設置、総合研究所の開設など、学内政治に直面するいくつもの案件にかかわらざるを得なくなっていた。当然、読む文献の量は激減し、何をしに大学にいっているのか分からないような状況だったのだが、その頃もう一つの興味深い報告を見つけた。Schoch G等による(J. Biol. Chem . 2001; 276: 36566-36574)4-p -クマリル CoAからカフェイルCoAへの変換経路に関する報告である。この報告は面白く、バカバカしい会議においてはこの文献を読んでいた。
彼らはシロイヌナズナ(Arabidopsis thaliana )を使い、p -クマリルCoAがシキミ酸の5位あるいはキナ酸の5位に存在する水酸基の攻撃を受けて、5-(p -クマリル)シキミ酸あるいは5-(p -クマリル)キナ酸となった後、この両化合物に対してオキシゲナーゼが働いてp -クマル酸部分の3位に水酸基が導入されること、さらにこのあと加水分解が起こってカフェイルCoAが生産されることを明らかにしていた。(図 28 )
今まで簡単に考えられてきたクマル酸からコーヒー酸への変換が、いわゆる正規の構成メンバーであるクマル酸、クマリルCoA、クマルアルデヒド、クマリルアルコールに対するオキシゲナーゼの作用で起こるのではなく、クマル酸とシキミ酸あるいはキナ酸の5位の水酸基の間で生成したエステルがオキシゲナーゼの基質となるだけでなく、生成したコーヒー酸エステルはCoA-SHの求核攻撃を受けてカフェイルCoAへと一挙に変換される。図 28において青い色で示した矢印の反応は起きていなかったのである。年間200億トンを超えるリグニン生合成は、上記の2つの経路で支えられていたわけだ。さらに、シキミ酸エステルを通ってもキナ酸エステルを通っても、反応に関与する酵素は同じである。
反応性だけを考えてもこの部分の変換に対する解釈もなかなか難しい。先にp -クマリル CoAとカルボニル基を反応性の高い形に活性化しておきながら、その部分を無視して芳香環に水酸化が起こるのは理解しがたいと書いた。ここで示されているのはクマリルCoAではなく生成したエステルに対するオキシゲナーゼによる酸化である。確かにアシルCoAよりもエステルの方が反応性は低いと思われる.
従って、先述した一つめの疑問はいくぶん解消したわけだが、その替わりにキナ酸やシキミ酸とのエステルがオキシゲナーゼの基質としてなぜ選ばれたのかというもっと難解な疑問が出現した。とはいえ、この疑問に答えが得られる可能性はさすがにないだろう。生物とはその辺りにあるモノを取りあえず使いながらなんとか辻褄を合わせてきただけであり、初めから必然性をもってあるモノを創ってはいないからだ。そこを敢えて糺したとしても、植物は ”Because it was there.”と答えるに違いない。ジョージ・マロリーの云った”Because it’s there.”とは、幾分以上に意味が違うにしてもである。
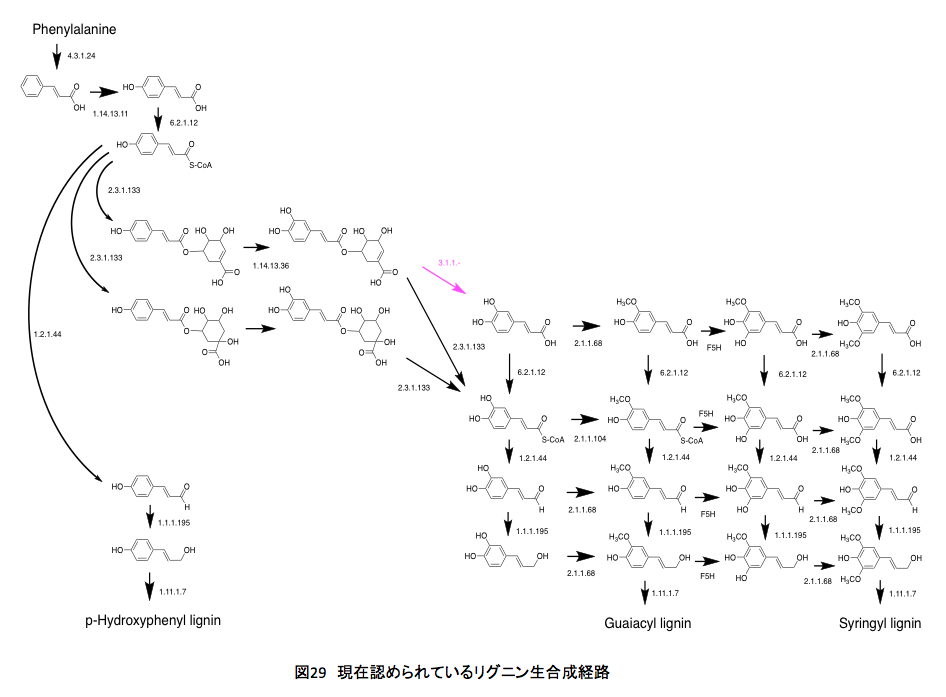
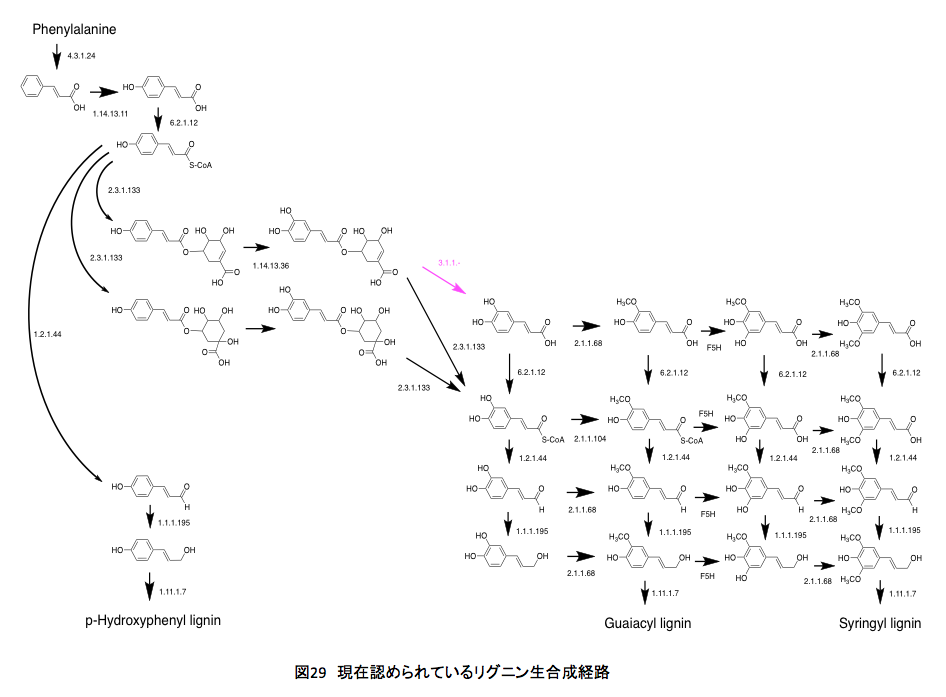
現在のところ、リグニンは図 29の経路を通って合成されると考えらる。シロイヌナズナとブドウ(Vitis vinfera )、ポプラ(Black cottonwood)の生合成系を比較してもほとんど変わりはない。いまよく分からないのはコーヒー酸への変換(EC3.1.1.-)がどの程度生合成量に関与しているかである。それにしてもクマル酸とコーヒー酸の間には、思いがけない断絶があったわけだ。最初に理解したと思った経路に比べるとかなり異なっているし、思いがけない部分も存在するが、まあそんなものとして納得せざるを得ないだろう。
時代が大きく動いている。髪を切って社会に旅立った私と同世代の古き若者たち、現在はどうしているのだろう。仕事を離れ、時間を持て余し、TVのまえに座り込む因業ジジババになってはいないだろうか。過去を振り返るのはかまわない。しかし、生きてきた経験と知識を次の世代に伝えるべく、前向きに生きようではないか。我々には過去と未来しかない。現在という無限小の時間に拘泥してどうする。変えられない過去に拘泥せずに、変えられる未来に向かうしかないのである。などと、格好つけた事を云いながら、日々肥料撒きと草刈りしかしていない。このイチゴ白書をもう一度、なにかしら血が騒ぐな。この曲が当時の荒井由実さんに本人にとってどのような意味合いを持つのかはわからないにしてもである。
https://www.youtube.com/watch?v=DX16jjF5KgU
過激な行動に参加する事はなかったが、イントロのような情景を見ながら大人とはなんだろうと考えていた。