炎帝神農は古代中国の三皇五帝の一人で、人々に医療と農耕の術を教えたという。その彼が、日々、百草の汁を舐めてその薬効と毒性を調べ続けた結果は、3世紀の初めに彼の子孫によって「神農本草経」として集大成されたのだが、それは、我が国で云えば卑弥呼の時代とほぼ同じである。これより古い黄帝内経や16世紀に上梓された本草学の集大成である「本草綱目」など、植物成分を毒あるいは薬として捉える歴史は思いもよらぬほど遠い過去にその源泉を持っている。
この植物を薬あるいは毒として使うという悠久とも云える伝統の下で、未だ持って解決されていない根源的問題がある。植物はなぜ、薬(毒)を作るのかという疑問である。但し、前の文章は決定的に不完全な文章である。植物だけではなく微生物も動物もそれ以外の生物も薬(毒)といえそうな物質を作るし、薬(毒)として作用する対象生物もまた微生物、植物、動物およびその他の生物と多岐にわたる。今までなされてきた説明は、主語と目的語の広がりの中から、ごく一部の例を抽出して説明して、個別の説明をしているに過ぎない。しかしながら、「ケシは何故「モルヒネ」を作るのか」などという懐疑は、「大麻は何故テトラヒドロカンナビオールを作るのか」、「キハダは何故ベルベリンを作るのか」、「ジギタリスは何故ジギトキシンを作るのか」などという疑問と全く同じカテゴリー・ヒエラルキーに属する懐疑である。一つ一つの問に特有な事象がある事は認めるにしても、全ての事象に通底する説明があるのではないかと考え続けてきた。
ただし、全ての生物の全てのケースを網羅して、今までの論理構成を基に説明しようとすれば、余りにも膨大なスペースが必要となるし、論理自体が相互に矛盾してしまう事は避けられない。従って、まず俎上にあげる問題を植物のアルカロイドに限定し、そこで成立した仮説が他の問題群に敷衍できるかどうかを検証するという形で進めて行く事にする。
アルカロイドとは
さて、薬学や天然物化学を専攻している研究者にとって、アルカロイドと呼ばれる物質群は、構造だけでなく生合成経路も複雑怪奇であるのみならず、薬としても毒としても働く化合物を含んでいる。アルカロイドの蠱惑的とも思える程の生理活性の広がりは、多くの研究者達を魅了し続けてきた。種々のアルカロイド、例えばモルヒネでありコカインでありストリキニンなどについて、それらの生合成経路や作用機作についての研究は目覚ましい進展を見せてきた。しかし、植物は何故、そんな化合物をつくるのだろうか?
植物の作るアルカロイド類、現在10,000種を超えるほどの化合物が知られているようだが、これら化合物群の存在理由に対して識者はどのような説明をしてきたのだろうか。こうは書いても、まずアルカロイドという用語をどのような範囲の化合物に対して使っているのかが明確でないと議論は始まらない。古い本を紐解けば、「植物塩基である」・「分子内に窒素を持ち、植物体内で生合成される大きな化合物群をいう。多くのアルカロイドは強い薬理活性を持つ。アルカロイドにはコカイン、ニコチン、ストリキニン、カフェイン、モルフィン、ピロカルピン、アトロピン、メタンフェタミン、メスカリン、エフェドリンそしてトリプタミンなどが含まれる。」などと書いてある。簡単にまとめると、「植物の作る塩基性の窒素化合物で、その多くが強い生理活性を持つ」となるだろう。
この定義は昔から知られている典型的な化合物群に対して成立するに過ぎないとはいえ、感覚的にはとても分かりやすい。だが、これでは近年の進歩について行けず、アルカロイドの全貌はつかめないだろう。ウェブ上に、帝京大学薬学部附属薬用植物園の木下武司氏によって非常によくまとめられたサイトがある。(http://www2.odn.ne.jp/had26900/index.htm) その中からアルカロイドについてという部分を少し改変して引用する。(意味が変わらないように気を付けたつもりだが、ご本人の意図と変わっていた場合は私の責任である)一寸長いが以下の《》で括られた部分である。
《1.アルカロイドの分類について
植物の中には分子内に窒素を含み塩基性を示す化合物を含むものがある。これらは古くからアルカロイド(alkaloid)と総称されているが、”アルカリのようなもの”という意味からわかるように語源的にはアルカリ(alkali)と同じである。和訳として「植物塩基」が用いられた時期もあったが、今日では動物起源のアルカロイドも知られていること、また以下に述べるように、一般にはアルカロイドと認識されていても塩基性でないものも実際に存在するので、この訳語を用いるのは適当ではない。これまでに単離されたアルカロイドの化学構造は極めて多様であるので、様々な分類法が提唱されている。最近、よく用いられるようになったのは生合成的起源による分類法であり、またこれが新しいアルカロイドの定義ともなっている。まず次の3つのタイプに大別されている(定義:最新の知見に基づいて2012年4月に修正)。
1)基本骨格、窒素源ともにアミノ酸に由来し、生合成過程でアミノ酸は脱炭酸を伴う
2)基本骨格がアミノ酸に由来せず、窒素源はアンモニア性窒素ないしアミンである
3)基本骨格、窒素源ともにアミノ酸に由来するが、脱炭酸を伴わないで生成する
1)に属するものを真正アルカロイド(true alkaloid)、2)に属するものをプソイドアルカロイド(pseudoalkaloid)、3)に属するものを不完全アルカロイド(protoalkaloid)と称し、真正アルカロイドについてはさらに前駆体となるアミノ酸の種類によって、例えばトリプトファン由来アルカロイドなどのように分類される(→詳しくはアミノ酸経路を参照)。プソイドアルカロイドとしては、ジャガイモの芽に含まれるソラニン(Solanine)などに代表されるステロイドアルカロイド(steroid alkaloid)、 アコナン系ジテルペンを母核しトリカブト毒素として名高いアコニチン(Aconitine)*やコウホネアルカロイドなどテルペンアルカロイド(terpenoid alkaloid)、 セリ科ドクニンジンの有毒成分コニイン(Coniine)などポリケチドアミン(polyketide amine)などがある。不完全アルカロイドとは、具体的には特殊な芳香族アミノ酸であるアントラニル酸、ニコチン酸を前駆体とするアルカロイドであるが、これらは生合成経路の上で脱炭酸を伴わない点で通常のアミノ酸を前駆体とするアルカロイドと区別される。ミカン科植物にはアントラニル酸を前駆体とするアルカロイド(例 ゴシュユアルカロイド)が特に多いことで知られる。不完全という名前を冠しているので生合成反応が未完成という意味で名付けられたようであるが、ゴシュユアルカロイドについてはトリプタミンとアントラニル酸のアミド縮合体にC1単位が導入されただけなので”不完全”というのは理解できるが、アントラニル酸、ニコチン酸由来のアルカロイドの中には複雑な生合成過程を経るものも多くあるので誤解しやすい。アントラニル酸、ニコチン酸はアミノ酸に似て非なるものとして”いわゆるアミノ酸”に含めないこともある(特に生化学領域では)ので、そのような定義に立てば不完全アルカロイドは「窒素源をアンモニアないしアミン、アミノ酸に由来しないアルカロイド」ということになろう。》
一寸長い引用だが、1)、2)の部分については歴史的な定義を基礎にした定義で、とても分かりやすく何の異論もない。3)の項は、例外規定としての位置づけであろう。しかし、ゴシュユアルカロイドの原料はアントラニル酸とトリプタミンである。私見だが、アントラニル酸にこだわらずトリプタミン由来のアルカロイドと見なせば、例外扱いする必要はなさそうに思う。ニコチン酸由来のアルカロイドについては、植物におけるニコチン酸の生合成がアスパラギン酸から誘導されるイミノアスパラギン酸と1,3-ジヒドロキシアセトンリン酸との反応で生成するキノリン酸を通って起こる事を考えれば、この部分に対応するアルカロイドもアスパラギン酸に由来するとして良いのではないだろうか。これは、出発物質を何処に置くかの議論に過ぎなくなるのかもしれない。
現実はどこまでもつながっているのにこれを分節して語ろうとする場合、「分節」のやり方には個人の恣意性が反映されるため、境界領域で意見の差違が現れるのは避けられないだろう。大まかにまとめれば、誰が見ても間違いなくアルカロイドと言える化合物群の周辺に、アルカロイドと見ても差し支えない物質群が存在し、その外側にアルカロイドかもしれない物質群、さらにその外側にアルカロイドとは思えない物質群が存在しているということに過ぎない。生合成による分類においては、色々な生合成系でつくられた物質が、さらに結合して生起した物質群を、複合系路による生成物として棚上げにしているではないか。そうした、棚上げを行う以外に分類に関する悩ましさを解決する方法はないと思う。ともあれこれからの議論においては、木下氏の分類による1、2、3の範囲で植物が作る物質群を対象とする。
モルヒネの存在意義
先述したとおり、植物が他の生物に対して薬になったり毒になったりする成分を何故作るのかという疑問は、子供でも思いつく何の変哲もない疑問なのだが、これに真摯に答えるのは途方もなく難しい。2017年に「植物はなぜ薬を作るのか」という、そのものずばりの本が文春新書から出版された。直ぐに購入し期待して読んだのだが、予想通りの内容で全く腑に落ちなかった。これは著者の記述を誹謗しているのではなく、著者と私の依って立つパラダイムの違いに由来するものである。例えばモルヒネ、ケシがモルヒネを作る理由を上記の本では以下のように説明している。47ページから該当する部分を引用すると、《モルヒネは血圧低下や呼吸抑制のような強い毒性作用もあり、動物がケシを大量に摂取した場合は死に至ります。植物であるケシにとっては、捕食者となる動物から自分を守るための防御物質がモルヒネであり、そのためにつくっているのです。》と書いてある。何となく分かりやすいといえばそうなのだが、どこかで誤魔化されているような気がしないでもない。多分間違っていると思う。
歴史生物学の提唱
私は、生物学において起こった事象の時間的な前後関係を重視する立場から、歴史生物学という新たな枠組みの必要性を提唱しているのだが、この歴史生物学においては、その名前があらわすように、生物界で起こった事象の前後関係(歴史性)を重視する。この立場から見ると、「1. 何らかの理由でケシはモルヒネを作った。」、「2. そのモルヒネは強い生理活性を持っていた。」「3. モルヒネが作られた後の生存競争において、ケシは有利であった。」という時系列になるに違いない。2、3の部分のストーリーは正しいかもしれないが、モルヒネの生理活性はケシがモルヒネを作った理由にはなり得ない。歴史生物学にとっては、ケシが最初にモルヒネを作った「何らかの理由」こそが問題であり、モルヒネの生理活性は事後に発生した付録なのである。少し長く複雑な話になるが、以下の論証に付き合って欲しい。
ケシは何故モルヒネを作るのか・・・歴史生物学からの答え
そこでまず、よく知られかつ典型的なアルカロイドであるモルヒネを例に、「ケシは何故モルヒネを作るのか」という疑問に答え、次にその論証が他の植物アルカロイドにも演繹できるかどうかを検証してみたい。ケシがモルヒネを作る理由を、モルヒネの生理活性に求めるのではなく、モルヒネが作られるプロセスの中に求めるとすれば、モルヒネの生合成経路を基盤におかなければならない。従って、幾分難解に感じる人が多いとは思うが、モルヒネの生合成経路を簡単に示す事にする。


イソキノリンアルカロイドというグループに分類されている一見複雑な構造を持つモルヒネだが、この化合物は2分子のチロシンから生合成される。そこでチロシンからモルヒネまでの生合成を、チロシンから(R)-Reticulineまでの系路と、(R)-Reticulineからモルヒネまでに分けて記述したい。何故 (R)-Reticulineで区切るのか?他意はない。ChemDrawの図1枚では描ききれなかったからに過ぎない。各段階に記載している数字は、ECナンバーである。まず、図-1から始めよう。
モルヒネの生合成に於いては、オキシゲナーゼの作用によって2分子のチロシンがフェノール性水酸基のオルト位に水酸基が導入されたL-Dopaとなった後、脱炭酸を受けて2分子のドパミンが生成する。1分子のドパミンは1級アミンオキシダーゼの作用を受け3,4-ジヒドロキシフェニルアセトアルデヒドに変換される。このアルデヒドは、反応を受けていないもう1分子のドパミンとの間で脱水縮合を起こしシッフ塩基を形成した後、キノリン環を形成して (S)-Norcoclaurineを形成する。(S)-Norcoclaurineに存在するテトラヒドロイソキノリン環の2位の窒素原子と6位の水酸基がメチル基転位を受けて(S)-N-Methylcoclaurineとなった後、もう一つの芳香環の3’位がモノオキシゲナーゼによる水酸化を受けて3′-Hydroxy-N-methyl- (S)-coclaurineへ、3′-Hydroxy-N-methyl-(S)-coclaurineの4’位の水酸基がメチル化を受けて(S)-Reticulineを与える。
モルヒネへ向かう反応系は、(S)-Reticulineから(R)-Reticulineへと異性化された後に進んでいくのだが、この一対の光学異性体間の変換反応はいくぶん不可解である。図-1に示した下側の系を通るのであれば一旦酸化して不整炭素を消した後、立体特異性を持つ還元酵素1.5.1.27の作用で(R)-Reticulineを生合成すると説明できるのだが、Laudanineの存在がどうも気になるのである。私が考察を進める際に指針としているKEGGにおいて、酵素2.1.1.291の反応の方向が(R)-Reticulineからも(S)-ReticulineからもLaudanine生成の方向に向かっているのである。この点については、平衡定数がLaudanine側に寄っていると云うことで、反応自体は可逆反応であると理解しておくことにする。それにしても7位の水酸基のメチル化あるいは脱メチル化に伴い、どのようなメカニズムで1位のラセミ化が起こるのか、この点については私自身が理解できていない。
図-2に移る。Salutaridine synthaseと呼ばれるP450に分類されるオキシゲナーゼにより、2つのベンゼン環の間でC-Cフェノールカップリングと呼ばれる結合が起こりSalutaridineが生成する。この反応については、要するに酸素原子上に発生したラジカルを結合する炭素上に動かせばよい話である。次にSalutaridineのカルボニル基が立体選択的に還元されてSalutaridinol、生成したSalutaridinolの水酸基がAcetylCoAによるアセチル化を受けて7-O-Acetylsalutaridinolになる。Acetylsalutaridinolのフェノール性水酸基による攻撃と協奏してアセトキシル基が脱離する反応が、酵素の存在なしに進行してThebaineが生成する。
モルヒネ生合成に於いては、メトキシ基を酸化的に水酸基に変更しながら反応を進める酵素が重要な役を果たしている場面があるが、ThebaineからNeopinoneへの変換はその例である。多分だが、メチル基が水酸化を受け生成したヘミアセタールがホルムアルデヒドとエノールへと変換される反応であろう。こうして得られるNeopinoneはより安定なαβ不飽和ケトンへと自動的に異性化しCodeinoneとなる。後は簡単である。Codeinoneは立体選択的にre面からのヒドリド還元によりCodeineに、Codeineに残っているもう一つのメトキシ基がやはり酸化的に水酸基へと変換されてMorphineが完成する。
Thebaineを基点とするもう一つの生合成系は、反応の順序が入れ代わった系と見ればよい。Thebaineの4’位に由来するメトキシ基が先に酸化的に水酸基へと変換されてOripavineとなった後、6位のメトキシ基が同じく酸化されてMorphinoneとなり、続いて立体選択的にre面からのヒドリド還元が起こりMorphineの生合成が完成する。
さて、これら2枚の図を連続して並べて上記の説明を付ければ、初学者や一般人を「これがモルヒネの生合成系だ」と納得させることは難しいことではない。専門家と言われる人でさえ、そう信じているように見える。「だが」である、次の図を見て先の系をモルヒネの生合成系として議論をすることができるのか。
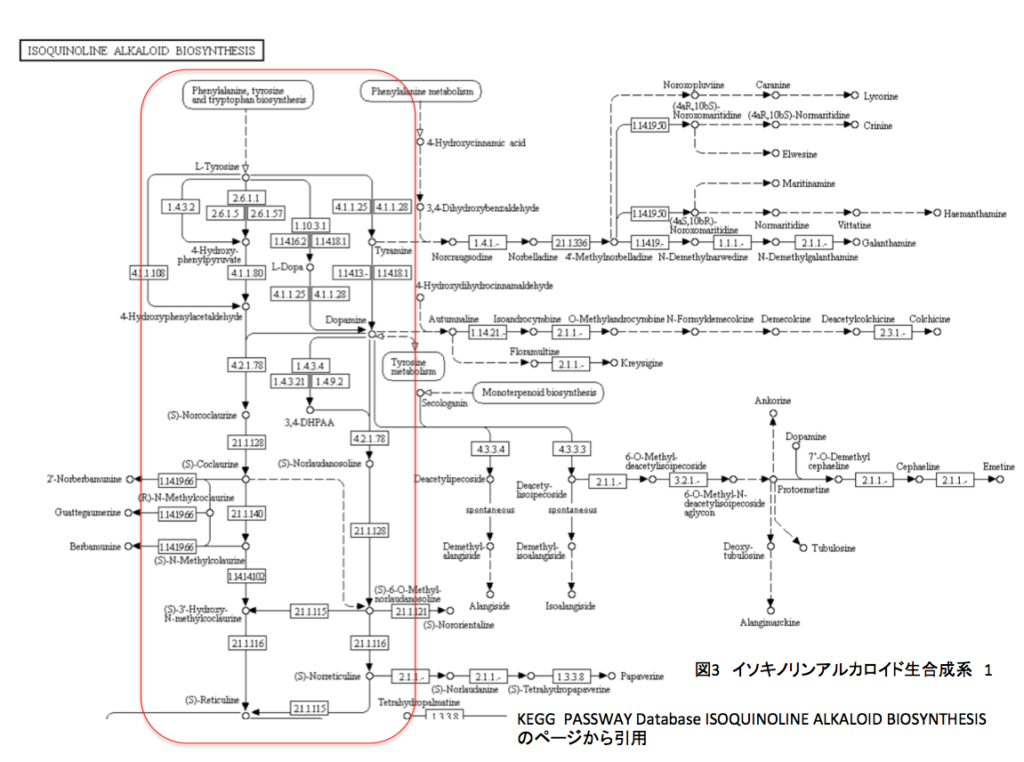

図3と図4はモルヒネ生合成系の外側に流れている代謝系を示しているが、赤い丸で囲んだ部分がモルヒネの生合成系の部分である。要するに、モルヒネという1つの代謝物が、ヒトに対して特異的な活性を持ち薬学という分野で大きな興味をもたれたが故に、その部分だけがモルヒネ生合成系として分節されていたに過ぎない。構造主義的な話になってしまった。しかし、モルヒネの作られる理由は、モルヒネの周囲に存在する近縁の周辺化合物にも演繹が可能でなければならないと考えるべきである。
さらにモルヒネが作られた後、そこで代謝が止まるのではない。モルヒネまでの代謝系をモルヒネ生合成系と分節したのは、モルヒネに興味を持った研究者の偏見に過ぎない。作られたモルヒネは一時的に蓄積されるにしろ、その分解系によって代謝されていくのである。故に、モルヒネが最終生産物であり、その含有量は増え続けなければならないとする思い込みは、分節をした研究者の脳内にある妄想に過ぎない。妄想は失礼かもしれない、偏見にしよう。
では、このモルヒネ生合成系のどの段階に、作られる理由があるのか。一言「この段階だ」と指摘すればそれで済む話なのだが、その指摘を納得してもらうためには、二つの事実を知っておいてもらう必要がある。一つは植物にとって窒素はどういうものであるかという理解であり、いま一つはごく初歩的な有機化学の知識である。
まず植物にとって窒素とは何であるかという話から始めたい。よく知られているように窒素、リン酸、カリは植物が多量に必要とする肥料の3要素である。植物は基本的には窒素飢餓状態にあるため、窒素肥料が与えられると生長は大きく促進される。もっとも、窒素分が充分に以上に与えられると、植物体は大きく、柔らかく、ジューシーになる。この結果、病虫害が多発することが多く、植物にとっては余り好ましくない。野菜類における窒素過剰は苦味をだす事が多いのみならず、硝酸体窒素による健康障害を引き起こしてしまう。我々にとって健康に良い野菜とは、少々見窄らしく生育不良のものが良いのかもしれない。
さて、窒素は地球上に無尽蔵とでも言えそうな量が存在する。何しろ大気の80%が窒素である。ところがこの窒素は、2個の窒素原子が3重結合をしている分子であり、窒素原子間の結合エネルギーが 225 Kcal/mol にもなる極めて安定な分子である。従って、植物はこの分子状窒素を直接には利用できない。植物が利用できる窒素は、近年アミノ酸も利用できるという話が流れているとは言え、アンモニア態窒素(NH4+)あるいは硝酸態窒素(NO3–)であると考えて大きく間違う事はないだろう。
従って、長い地球の歴史の中で植物が利用することができた窒素は、雷(放電)に伴い空気中の窒素から生成する窒素化合物に由来するものであり、いま一つはいくつかの種類の真正細菌(シアノバクテリアも含めている)と一部のメタン細菌が固定した窒素に由来するものであった。現在では、ハーバー・ボッシュ法によって、生物が生産するのとほぼ同量のアンモニアが工業的に生産されている。これは極めて多量のエネルギーを必要とする方法であり、現在人類が消費するエネルギーの1%がこの窒素固定反応で消費されているという。少しだけ話がそれるのだが、この窒素固定反応が本当に人類は幸せにしたのかどうか、なかなか一概には答えられない問いであるようだ。
フリッツ・ハーバーとカール・ボッシュによって成し遂げられ、歴史上最も重要な発明の1つであるこの窒素固定法だが、ノーベル賞を受賞した後の2人の後半生は哀しい。ハーバーはユダヤ人であったために、ナチスによって母国ドイツから追放され数カ国を転々とするが、毒ガス兵器の開発に携わったことで科学者仲間からの風当たりが強く、失意の中、イスラエル建国に参加しようと移動中にスイスで客死した。(1934年バーゼル)ボッシュはBASFの経営陣の一員としてナチスの方針に引きずられていく状況に心を病み、彼もまた失意の中で他界する。(1940年ハイデルベルグ)
話を戻そう。植物は基本的に窒素飢餓状態にあるため、これを捨てる事はせず有効に再利用するシステムを作り上げている。植物の老化した組織では機能していたタンパク質や核酸などの含窒素生体高分子は、役目を果たした後に分解され、篩管を介して若い組織に輸送され再利用されている。この組織間の窒素輸送は窒素転流と呼ばれているのだが、篩管を流れる窒素の主な形態はグルタミンとアスパラギンである。つまり老化した組織では、グルタミンやアスパラギンの生合成、特にグルタミンの生合成が活発に行われているわけである。
一見話が飛ぶように思われるかもしれないが、光合成において主役を演じているのはリブロース-1,5-ビスリン酸カルボキシラーゼ(ルビスコ)と呼ばれる幾分以上に奇妙な酵素である。このルビスコ、ラフな言い方で問題が残ることは承知しているが、二酸化炭素と酸素をうまく区別できず反応部位へ取り込むため、二酸化炭素を取り込んだときはカルボキシラーゼとして働くが、酸素を取り込んだ場合はオキシゲナーゼとして働いてしまう。この現象の意義については場を改めて述べる予定である。さらに、ルビスコは、酵素としては異常とも云えるほど基質回転速度が低い。従って、植物は大量の酵素を必要とする事になり、植物の葉中に存在するタンパク質の3割ほどをルビスコが占める。その量の多さ故に、時としてビスコを窒素のシンクとして見なす場合もあるほどである。
このルビスコは葉っぱの老化に伴い分解を受け、その窒素部分は師管を通って新葉や種子へと転流されるのだが、この時窒素はグルタミンやアスパラギンの形を取っている。ではルビスコというタンパク質のアミノ酸組成がグルタミンやアスパラギンに偏っているかと言えばそんな事はない。下にアラビドプシスのルビスコを構成するスモールサブユニットとラージサブユニットのアミノ酸組成を示す。
Ribulose bisphosphate carboxylase small chain 1A 180 aa
Met 6 Ala 14 Ser 15 Leu 11 Thr 11 Val 10 Pro 12 Gln 5 Phe 10 Asn 9 Gly 11 Lys 12 Arg 7 Asp 7 Ile 10 Trp 4 Tyr 8 Glu 11 Cys 5 His 2
Ribulose-bisphosphate carboxylase large chain 479 aa
Met 8 Ala 43 Ser 19 Leu 41 Thr 33 Val 33 Pro 24 Gln12 Phe 22 Asn 15 Gly 47 Lys 24 Arg 27 Asp 26 Ile 21 Trp 8 Tyr 17 Glu 35 Cys 9 His 15
見ての通り、これらのタンパク質のアミノ酸組成がGlnとAsnに偏っているわけではない。葉っぱの中で働いている他の酵素やタンパク質についても状況は同じである。では窒素転流において何が起こっているのか。
面白いといえば面白いのだが、アミノ酸の分解と再利用という問題には現代文明の持つ病的側面を露骨に見る事ができる。Buchanan, Bob B. /Gruissem, Wilhelm /Jones, Russell L.等による1,200ページを超える大著―「Biochemistry & Molecular Biology of Plant」やHans Walter Heldt(金井龍二訳)の「植物生化学」などを参照しようとしたのだが、窒素の同化に続くアミノ酸合成、アミノ酸からのタンパク質の合成に関しては詳しく書いてあるものの、その分解・リサイクルについて包括的な視点から書いたパートは存在しない。作って使う事には精力を傾けるにもかかわらず、使った後の処理や廃棄を徹底的に軽視してきた我々の文明の病理を端的に示しているように見えてしまう。アミノ酸の分解に関してはリグニンやアルカロイドの生合成の部分に少しだけ書いてあるのだが、それはアミノ酸の分解という位置付けではなくリグニンやアルカロイド生合成の初発反応という位置付けである。作る事が大事であり壊す部分は微生物に任せて放置ということであろう。
一般的な生化学の教科書にアミノ酸分解についての一節が存在する。しかしながら、そこにおける記述は動物(おおむねヒト)における分解系路であり、アミノ酸における炭素鎖からTCA回路へ向かう系路についての説明が中心となる。この分解系で発生するアミノ基由来のアンモニアについては、アンモニアの毒性故にいわゆる尿素回路を使って無毒な尿素に変換した後、体外へ排泄するという。書籍によっては、窒素の排泄形態と動物の水利用の自由度を関連付けて記述している場合も存在する。
だが、植物にとってアンモニアのみならず尿素回路の生産物である尿素も重要な窒素原である。この事実を中心に置いたアミノ酸分解系の解釈はなされていない。どうやら植物が行うアミノ酸分解については、自ら手を下して纏めるしか仕方がないようだ。という事で、植物に存在するアミノ酸から先の代謝を列挙することにする。
1. リアーゼによる脱アミノ反応
フェニルアラニンアンモニアリアーゼ(PAL)、チロシンアンモニアリアーゼ(TAL)、あるいはアスパラギン酸アンモニアリアーゼなどに代表されるEC第4群に属する酵素群で触媒される反応で、アンモニアを脱離しながら二重結合を形成する。通常はリグニンやリグナンなどフェニルプロパノイド生合成の初発反応として記述される場合が多く、莫大な量のPheやTyrが分解を受ける。しかし、ここで脱離するアンモニアはグルタミン酸やグルタミンの生合成に再利用されているようだ。
2. アミノ酸デカルボキシラーゼによる脱炭酸反応
アミノ酸のカルボキシル基を脱炭酸して一級アミンを生成する反応である。通常は動物や微生物においてチラミン、ドパミン、ヒスタミン、トリプタミン、γ-アミノ酪酸、など種々の活性を持つアミン類を生成する反応として記述される事が多い。しかしながら植物においても同じ代謝系が存在するだけでなく、フェニルアラニン、チロシン、トリプトファン、オルニチンやリジンに由来するアルカロイド群生合成の初発反応として認識されている。余り問題にされる事はないのだが、アミノ酸デカルボキシラーゼによる脱炭酸反応で生成するこれらの1級アミン類は、脱アミノ反応を受けてアルデヒドへと変換される。この変換にはα-ケトグルタル酸がアミノ基の受容体となる反応と、酸化的に脱アミノを受けアルデヒドとアンモニアに変換される反応があるのだが、植物は酸化的脱アミノ反応の方を使っているようだ。モノアミンオキシダーゼあるいはジアミンオキシダーゼが触媒するこの反応においても、生成したアンモニアはグルタミン酸やグルタミンなどの生合成に使われるため、窒素が無駄に捨てられるわけではない。
3. グルタミン酸デヒドロゲナーゼによる酸化的脱アミノ反応
NAD(P)+存在下にグルタミン酸を基質として、α-ケトグルタル酸とアンモニアとNAD(P)H2を生産する反応である。植物においてはミトコンドリアや維管束鞘に偏在し、α-ケトグルタル酸が不足した場合の供給反応であると予想されており、いわゆるグルタミン酸分解反応とは考えられていない。
5. アスパラギン、グルタミンのアミド部分の加水分解
アスパラギン、グルタミンのアミド部分を加水分解してアスパラギン酸あるいはグルタミン酸に導き、それらの代謝系に乗せる反応である。
4. トランスアミナーゼによるアミノ基転移反応
アミノ酸とα-ケト酸との間で起こるアミノ基転移反応である。この反応はアミノ酸の分解であるのか生合成であるのか判断が難しい。少なくとも、ルビスコを始めとしたタンパク質がタンパク質を構成アミノ酸まで分解された後、グルタミンあるいはアスパラギンとして集約され師管を通って転流する場合、集約を担うのがこの反応である。とはいえ、TCA回路からスピンアウトしたα-ケトグルタル酸に始まる膨大なアミノ酸や核酸類の生合成を担っているのもこの反応である。窒素転流という観点からみれば、α-ケトグルタル酸あるいはオギザロ酢酸がアミノ基を受け取るα-ケト酸として重要視される。植物細胞では4種類のアイソザイム(細胞質型,ミトコンドリア型,プラスチド型,ペルオキシソーム型)の存在が知られている。この反応はアンモニアを生成する反応ではないが、アミノ基を再利用しやすい形に変えて行くという意味で記載した.
一寸ばかり複雑かもしれないが、要するに植物は常に不足しがちな窒素を無駄なく回収し再利用する窒素サルベージ系を持っていると考えて良い。いやこれは私の立場からの認識であり、今まではアミノ酸の分解反応、相互変換反応として記述されていたものである。よく似た窒素回収システムが核酸分解においても機能しているのだが、複雑になるのでここでは触れない。
植物は窒素を無駄なく回収し再利用するスキームを持つという視座から見たとき、このスキームからスピンアウトしていく窒素がモルヒネ生合成経路には存在する。モルヒネ生合成系の前半部に存在するドパミンと3,4-ジヒドロキシフェニルアセトアルデヒドとの反応である。有機化学の基礎的知識として、1級アミンはアルデヒド類とすぐに反応してシッフ塩基を与えるし、2級アミンはイミニウムカチオンを与える。この場合はドパミンと3,4-ジヒドロキシフェニルアセトアルデヒドがすぐに反応してシッフ塩基を形成した後、キノリン環を形成して (S)-Norcoclaurine を形成するのだが、シッフ塩基を生成する時点で、窒素のサルベ-ジシステムからスピンアウトしてしまったと見るわけである。この場合、細胞内においてドパミンがアミンオキシダーゼの基質であり3,4-ジジヒドロキシフェニルアセトアルデヒドが生成物である。つまり両化合物は極めて近接した位置で共存している。その条件下においては、有機化学の常識に従えば両化合物が反応しないはずはない。
さて、前述したように植物は基本的には常に窒素不足の状況にあると考えて良い。少しだけ一般化した話だが、ある植物が何故アルカロイドを作るのかという疑問に対して、そのアルカロイドの生理活性を根拠とする時系列錯誤的な説明だけではなく、アルカロイドを窒素の老廃物、あるいは何らかの解毒作用の結果であるとする説があった。アルカロイドの存在意義を説明する根拠とするには余りに多様すぎる生理活性に対する逡巡が、アルカロイドは窒素廃棄物というごく単純な説をもたらしたように見える。しかし、アルカロイドの含有量が次第に増加していくのでなく季節によって大きく変動するだけでなく、窒素飢餓状態にある植物が窒素を捨てるはずがないとする常識から、この考え方は殆ど見捨てられた状態にある。しかし、この廃棄物説は捨て去るには惜しい仮説である。私の視座から見ると結果的に捨てていると判断せざるを得ない部分があるからだ。なかなか理解されないかもしれないが続けることにする。
私は、アルカロイドは植物の窒素のサルベージ系路からスピンアウトした化合物であると捉えている。先祖返りの窒素廃棄物説に少しだけ似ているが、単なる廃棄物として捉えているわけではない。植物は基本的に窒素飢餓状態にあるが故に、窒素を捨てたくはない生物である。従って、長い歴史の中で窒素を回収し再利用するサルベージ系路を発達させてきた。にもかかわらず、そのサルベージ系の中で生成したアミンとアルデヒドが意図に反して勝手に反応してしまう事で、そのスキームからのスピンアウトが起こってしまったと理解する。言い換えれば、アルカロイドは植物の意図しない窒素廃棄物であるという事になる。「意図しない」という言葉の中に、捨てたくない植物側の事情が反映していると受け取って欲しい。
では、このアルカロイドは窒素サルベージ系からのスピンアウト物質説が、その他のアルカロイドに対しても成立するかどうかを検証しよう。これからの議論においては、真性アルカロイド、プソイドアルカロイド、あるいは不完全アルカロイドなどという分類には拘らず、それらの生合成において、植物の意図しない窒素のスピンアウトが含まれているかどうかが問題である。
リジンを起源とするアルカロイド群
塩基性アミノ酸であるリジンは脱炭酸を受けてカダベリン(Cadaverine)と呼ばれるジアミンに変換される。長年慣用名で慣れてきた人々はカダベリンで違和感はないかもしれないが、IUPAC命名法に従ってペンタン-1,5-ジアミンと書いた方が分かりやすいかもしれない。そして代謝はカダベリンで止まるのではなく、ジアミンオキシダーゼの作用で酸化的に脱アミノされてδ-アミノペンチルアルデヒドを生成する。植物としてはもう一つの1級アミンも酸化的に脱アミノしてグルタルアルデヒド、IUPAC命名法では 1,5-ペンタンジアールヘと変換し、この2段階の反応で生成するアンモニアをグルタミンへと変換して窒素転流系に乗せるのが望ましい。しかし、ことはそう都合良く進むわけではない。
リジンが脱炭酸を受けカダベリン(Cadaverine)と呼ばれるジアミンに変換される。ここまでは問題はない。そしてカダベリンはジアミンオキシダーゼの作用で酸化的に脱アミノされてδ-アミノペンチルアルデヒドを生成する。δ-アミノペンチルアルデヒドには1級アミノ基とアルデヒド基が存在する。化学反応は反応に関与する官能基が出会うというより衝突して起こるのだが、δ-アミノペンチルアルデヒドは4個の炭素から成るメチレン鎖の両端に反応しやすいアミノ基とアルデヒド基が存在する上に、反応生成物が安定な6員環になるという環化反応を起こすには最適な形をしているのである。従って、δ-アミノペンチルアルデヒドは触媒無しに直ぐに反応して1-Piperideine(2,3,4,5,-Tetrahydropyridine)に変化してしまう。こうなると、5位にあった窒素原子は、植物が構築している窒素サルベージ系路からスピンアウトしてしまうわけである。
話はそれだけでは済まない。δ-アミノペンチルアルデヒドはさらに酸化を受けてアンモニアを窒素サルベージ系路へ流し、グルタルアルデヒド(1,5-ペンタンジアール)を形成するのだが、この反応性の高いジアルデヒドは原料であるδ-アミノペンチルアルデヒドのアミノ基とシッフ塩基を形成した後、C=N二重結合の還元に続く閉環反応を受けてキノリチジン環をもつアルデヒドをあたえる。そしてこのアルデヒドが先に作られていた1-Piperideineによる付加反応を受けた後、幾つかの段階の反応を経てマトリン(Matrine)となる。
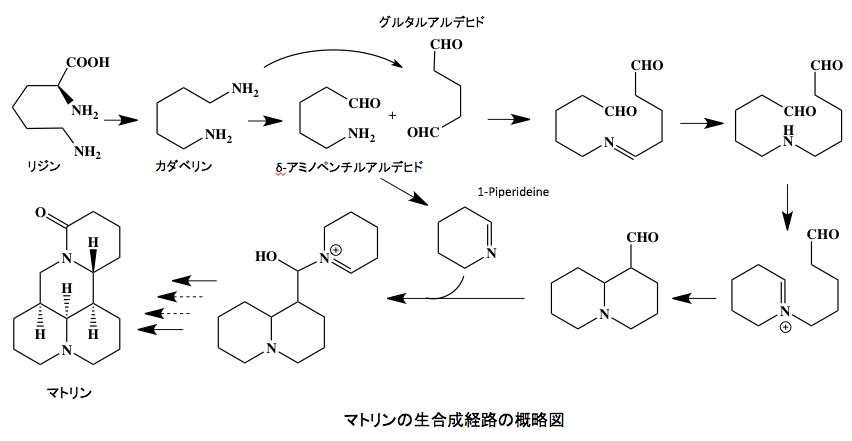
全体を通してみると3分子のリジンの6個のアミノ基の中で、4個がアンモニアとして回収され、2個が望ましくないアミノカルボニル反応によりサルベージ経路から抜け落ちた事になる。マトリンは苦い。舐めると頭がクラクラするほど苦いがゆえに、これを含むマメ科植物にはクララという名が付いたという。クララが苦いマトリンを作り生存に有利になったなどと云う説明は後付けの説明に過ぎず、クララの体内でアルデヒドとアミンが自動的に反応したがゆえに窒素のサルベージ系路からスピンアウトし、クララにとっても思わざる廃棄物ができてしまったと考えるのが理性的であろう。
蛇足だが、この苦いクララを食草とするオオルリシジミは、クララの自生地が野焼きの減少と草地改良の拡大によって激減したがゆえに絶滅危惧種になってしまった。オオルリシジミにしてみれば、苦さを克服してクララを食草としたにもかかわらず、クララ自体が激減したのでは立つ瀬がないだろう。尤も、この蝶がマトリンを苦く感じていると断定するのは早とちりかもしれない。ウリ科植物に含まれるヒトにとっては苦み成分であるククルビタシンをウリハムシの仲間は好んで食べる事が知られている。蓼食う虫も好き好きという事で、虫の感覚については棚上げにしておくのが良さそうだ。
マメ科植物であるルピナスの仲間は、リジンが脱炭酸を受けて生成したカダベリンからキノリチジンアルカロイド類である有毒な17-オクソスパルテイン、ルパニンを通って13-(2-メチルクロトノイル)オキシルパニンなどを生合成する。このキノリチジンアルカロイド生合成の初発反応も興味深い。3分子のカダベリンには6個のアミノ基が存在するのだが、そのうち4個のアミノ基はピルビン酸へと移されてアラニンとして再利用されるのだが、残った2つのアミノ基が再利用系から外れて17-オクソスパルテインの縮合環内に取り込まれている。
いくつかスピンアウトの例を続けよう。
アルギニンを出発物質とするアルカロイドも多数存在する。これらのアルカロイドは、リジン由来のアルカロイドと同じく、アルギニンが脱炭酸されたプトレッシンを通るのだが、多くの場合プトレッシンの片側のアミノ基はメチル化を受ける。生成物はであるN-メチルプトレッシンは1級アミンオキシダーゼの触媒下にアンモニアを放出して4-アミノメチルブタナールへと酸化されると同時に、生成したアンモニアは窒素サルベージ系へと回収される。そこまでは良いのだが、リジン由来のδ-アミノペンチルアルデヒドの場合と同じく、N-メチルプトレッシンの酸化生成物である4-アミノメチルブタナールにおいては、1級アミン以上に求核性の高い2級アミノ基がアルデヒド基のγ位に存在するため、すぐに閉環反応を起こして1-メチルピロリ二ウムを生成する。窒素サルベージ系からのスピンアウトをメチル化が起こった時点と考えるか、1-メチルピロリ二ウムの生成時点と考えるかは人によって違うかもしれないが、少なくとも1個の窒素原子がスピンアウトしてしまうと考えられる。
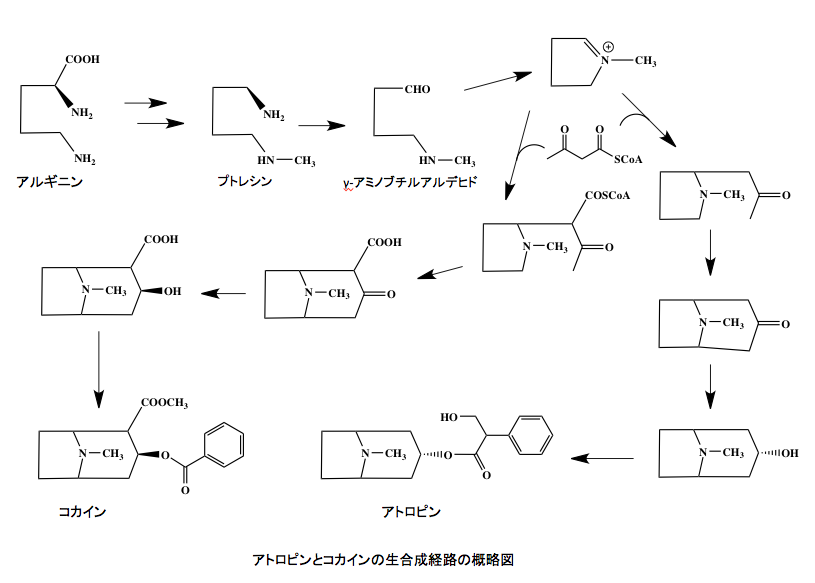
1-メチルピロリ二ウムは窒素原子上に正電荷を持つため、2位の炭素が求核置換を受けやすくなっているため、色々な生体成分が2位の炭素に結合後、幾つかの反応を経てニコチン、ヒグリン、トロピノンを通って、アトロピンやスコポラミン、あるいはクスコヒグリン、そして重要な麻薬であるコカインなど、種々のアルカロイドへの代謝系が連なっている。我々は、生産されたアトロピン、スコポラミン、クスコヒグリン、そしてコカインなどの様々な生理活性に幻惑され、それらの活性をもってアルカロイドの存在意義を考えようとしてきたのだが、それらは窒素のサルベージ系路から思いがけなく外れて生成した4-アミノメチルブタナールあるいは1-メチルピロリ二ウムに端を発する新たな代謝系産物と考えることにより、合理的な説明が可能になると思う。
アルカロイドの中でトリプトファンに由来するアルカロイド群もまた、非常に興味深い生理活性を持つものが多い。特にモノテルペンであるセコロガニンとトリプタミンから生合成されるアジュマリン、レゼルピン、ヨヒンビンなどがよく知られているのだが、これらの生合成もトリプトファンが脱炭酸を受けて生成するトリプタミンがセコロガニンのアルデヒド基とシッフ塩基を形成するところに端を発している。本来ならトリプタミンをアミンオキシダーゼで酸化し、生成物であるアンモニアをサルベージ系に乗せるのが植物にとっては好ましいであろうにも拘わらず、トリプタミンのアミノ基がセコロガニンのアルデヒド基と望ましくない脱水縮合を起しシッフ塩基を形成してしまっている。トリプトファンに由来するが、インドール環ではなくキノリン骨格を持つストリキニンやキニン、キニジンの場合も、上記の議論は成立する。
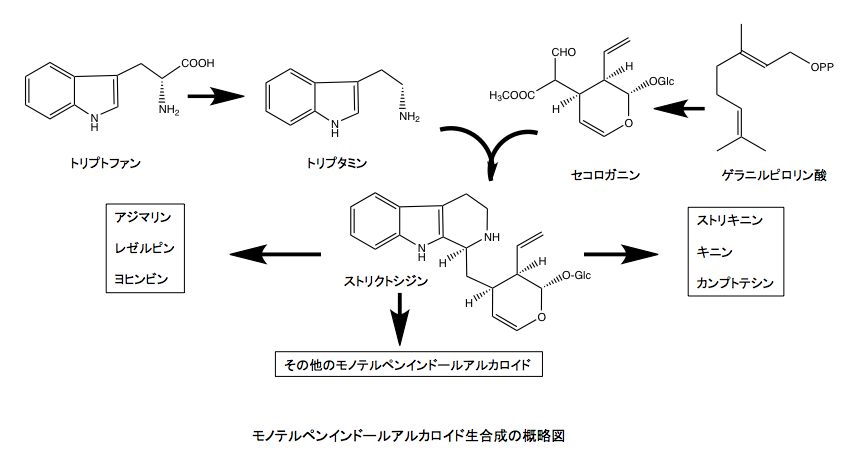
これ以上の議論はしない。読者が自ら興味を持つアルカロイドについて、アルカロイドは窒素サルベージ系からスピンアウトした物質であるとするこのアルカロイドスピンアウト仮説が成立するかどうかを検証してもらえば良い。
結論
結論として纏めよう。先に述べたように、筆者にとって「なぜ植物はアルカロイドを作るのか」という疑問は、長い間全く説明のつかない難問であった。アルカロイドだけではなく他の多くの生理活性物質に対して、生理活性を原因として語られるアドホックな説明は、掃いて捨てても捨てきれないほどあった。ただアルカロイドについては、いくぶん控えめに書いてあるものが多い。何しろアルカロイドという物質群は「毒と薬の宝庫」である。化合物の持つ多様な活性から意義を説明する理由付けの材料には事欠かないように見える。しかしながら、アルカロイドの活性を示す対象生物が、周辺に棲息する動物・昆虫・微生物・他の植物だけではなく、生産する植物とあまり利害関係のなさそうなヒトまでも含まれていたことがネックになっていたようだ。(動物の一員であるヒトをワザワザ別立てで記述することに幾らかの心理的抵抗はあるが、普通の人にとっては動物とヒトは違うものだろう。分かりやすくするために、別物として記述する)
ケシがモルヒネをつくる目的を、ホモサピエンスを桃源郷に誘うことに求めるのは無理だろう。マタタビがアクチニジンを、ネコを酩酊させるために作るはずもない。ネコが酩酊したらマタタビに何の利益があるのだろう?あるアルカロイドに対して、生合成された後に顕在化する生理活性をもって、そのアルカロイドが作られる理由とするアドホックなスキームは使いづらかったようだ。つまり、生理活性に存在意義を求めるこの論法が、一部の二次代謝産物に対し辛うじて機能しているように見えるにしても、アルカロイドに対する説明に於いては脆くも破綻していたのである。
筆者は、生物学において起こった事象の時間的な前後関係を重視する歴史生物学という新たな枠組みを提唱している。この枠組みにおいては、生物界で起こった事象の前後関係(歴史性)を重視する。モルヒネでも他のアルカロイドでも、あるいは他の二次代謝産物であっても、ある生物が他の生物への毒作用(薬理作用)を意図して生合成するはずはない。何らかの必然性によって、アルカロイドが、あるいは二次代謝物質が生合成される。その後に、その代謝物質の他の生物に対する薬(毒)作用が発現するという時系列での話でなければならない。つまり、アルカロイドあるいは他の二次代謝物質が生合成される理由は、それらが作られる生合成経路の中になければならない。それが、いろいろな代謝系を理解するに当たって、歴史生物学が要請する最低限の条件となる。
さらに、植物という生き物が常に窒素飢餓状態におかれているという認識である。移動する事がかなわず、肥料成分の摂取を根圏に限定されている植物には、窒素を回収し再利用するサルベージ系路が発達している。α-ケトグルタル酸、グルタミン酸、グルタミンを主要な成分とするこの窒素サルベージ系については、窒素サルベージ系という観点から言及される事は殆どなかった。しかし、アミノ基転移と、炭素鎖から脱離したアンモニアを再利用が組み合わされたこのサルベージ系こそが、植物の生活環を支えている事は間違いない。植物は窒素を無駄にする事は極力避ける生き方をしているのである。
上に書いた二つの条件を前提にモルヒネの生合成系を眺めると、チロシンに由来するドパミンとその酸化生成物である3,4-ジジヒドロキシフェニルアセトアルデヒドとの反応が自発的に起こる反応であるが故に、植物の意図に反して窒素再利用系からスピンアウトしていく望ましくない反応である事は自明であろう。生成したシッフ塩基は、その高い反応性故に周囲に存在する酵素群の作用を受け、様々な修飾を受け続けるのである。その途中に出現したモルヒネという化合物は、最終産物ではない。これを最終産物であると認識するのは、その生理活性に幻惑されモルヒネ生合成系などと命名して現象を理解しようとした研究者の錯誤である。構造主義の考えに従えば、恣意的分節がもたらした硬直した認識であると言っても良いだろう。
現実は、モルヒネ生合成系に続いてモルヒネの分解系が続いているのである。植物の生長と老化に伴い、モルヒネ含量が増減するのはおかしいとしてアルカロイド窒素廃棄物説を一蹴した研究者の方が間違っていたのである。二酸化炭素と水、そしてアンモニアから開始された代謝系は、種々の複雑な化合物となって植物の命を支えた後、また二酸化炭素と水、そしてアンモニアに戻って行く。研究者達はその一部を恣意的に切り取って空想をもてあそぶ『臆断の虜囚』になっていたと考える。そう考えれば、モルヒネを通って進んで行く分解系さえも窒素サルベージ系のバイパスであると考えて良いのかもしれない。
こうした所論をもって他のアルカロイドの生合成系を精査すると、どの場合においても、生合成系の始めの段階に同じようなアミノカルボニル反応が存在し、その段階からの窒素サルベージ系からのスピンアウト現象が存在する。とすれば、植物にとってのアルカロイドは、「窒素サルベージ系からのスピンアウト生成物」あるいは「窒素サルベージバイパスにおける中間体」として位置付けられるだろう
さらに重要な事は、いままで生理活性を示さないが故に黙殺されてきた極めて多くの代謝中間体に、その存在意義を付与する事ができる。全ての中間代謝物は、生理活性の有無に拘わらず、それぞれが重要なレゾンデートル「存在意義」を持っていたのである。
ああ、疲れた。馬鹿馬鹿しいコロナ騒ぎの中で学問的な情熱を持ち続けるのは結構難しい。でも、馬鹿馬鹿しいコロナ騒ぎに異論をもち細々と書き続けるのであれば、植物の代謝に伴う生産物に関するアドホック極まる説明群に対しても批判をし続けなければならないと考えた。現役生活を青臭い書生論によって打ち切った著者にとっての残り火みたいなものである。
