そこで話をアブシジン酸に戻すことにする。当時すでに、アブシジン酸は器官脱離を促進し、気孔の開閉を制御することによって蒸散を制御し、発芽と生長を抑制し、植物に耐寒性を付与し、光合成を抑制し、休眠を誘導・維持するなど、何とも多くの機能を合目的的に発揮する抗(環境)ストレスホルモンとして認められていたが、このセクションでは、アブシジン酸はホルモンであるという“枷”を少しゆるめた観点から再検討してみたい。
当時の植物生理学の教科書や、植物生理学に関する論文において、植物ホルモンであるアブシジン酸は、「蘚類〔スギゴケの仲間〕以上の高等植物分布する」と書いてあった。では、苔類〔ゼニゴケの仲間〕以下の下等植物にはアブシジン酸に対応する制御物質は存在するのだろうか。上に述べたアブシジン酸の活性の中で、器官脱離とか気孔の開閉は考えにくいにしても、その他の生理作用は下等植物においても必要に思える。では、そのような活性を下等植物で担保している物質はあるのか。いろいろな文献を読んでいた時に出会ったのがルヌラリン酸である。
この化合物は、Valio等が1969年に報告していた化合物で、ミカズキゼニゴケ(Lunularia cruciata)の生長を抑制し、光周性を制御する物質として単離した物質である。さらにルヌラリン酸は基本的には苔類以下の下等植物に分布し、1971年にはR. J. Pryceが下等植物においてアブシジン酸と同じ作用を示す物質であるのではないかとする報告を出していた。似たようなことを考える人がいるものだと思いながらPryceの報告を読んだわけだが、生理活性が似ているということからの推測だけで、実験的な証明は全くされていなかった。そこでアブシジン酸とルヌラリン酸との比較を行ってみることから研究を開始した。
分布について
先に書いたように、基本的にアブシジン酸は蘚類以上の高等植物に分布し、ルヌラリン酸は苔類以下の下等植物に分布すると書いてある。(図3-1)
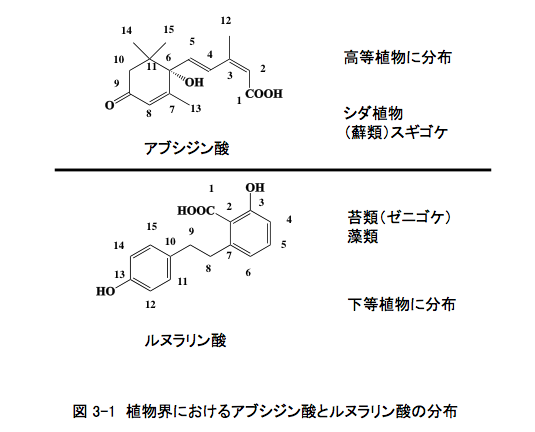
しかし、どんな規則にも例外はある。当時においても、ルヌラリン酸が高等植物であるアジサイの根の抽出物中にhydrangeic acid とともに含まれることが知られていたし、1976年には藻類中にアブシジン酸が存在することも明らかにされていた。1980年代から1990年代にはいると、アブシジン酸は苔類、緑藻、シアノバクテリア、ツノゴケ、地衣など植物に含まれるだけでなく、植物病原性糸状菌であるCercospora属細菌が多量のアブシジン酸生合成能力を持つこと、哺乳動物である豚とラットの脳、ブタの心臓・肝臓・腎臓にも存在することが報告された。2,000年代になってからの話は、もう少し進んだ段階で議論することにする。
一方、ルヌラリン酸の高等植物での分布例はあまり増えることはなかったが、ヤムノイモにムカゴの休眠を誘導するルヌラリンやバタタシンあるいはルヌラリン酸と非常に似たヒドランゲ酸がアジサイの仲間に分布するなど、高等植物にルヌラリン酸と構造的に類縁性をもつジヒドロスチルベンやスチルベン類が分布することから、当初の分布の話などどこかに行ってしまった様な状況になってしまった。(2009年には、セロリ中にルヌラリン酸とルヌラリンが存在する報告も出された)
しかし、一旦アブシジン酸が植物ホルモンと決まった以上、アブシジン酸とルヌラリン酸の生物界での位置付けや分布に関して、改めて議論するという風潮にはないようだ。しかし、こうした状況だからこそ、これらの現象を整合的に説明できる仮説が必要なのではないか。ある意味で、私は生物界における幻の大統一理論を夢見ているのかもしれない。
アブシジン酸とルヌラリン酸は化学的に似ているか?
アブシジン酸とルヌラリン酸の構造式をもう一度図3-2に示す。ルヌラリン酸をどう描くかで、この化合物は全く異なった印象を与える。
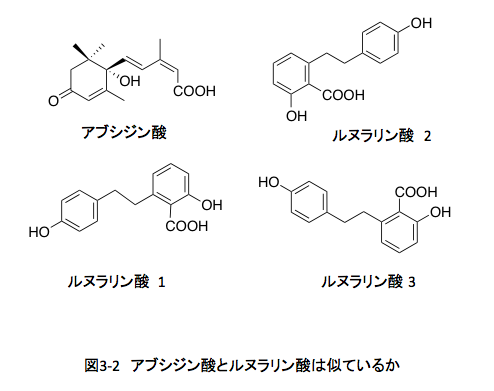
ルヌラリン酸2は、天然物活性物質〔東京大学出版会〕に準じて描いているし、ルヌラリン酸3は科学技術振興機構の日本化学物質辞書Webに準拠している。こんなブログを読むヒトには釈迦に説法かもしれないが、描き方が違うだけで同じ化合物を示している。この2つを見てアブシジン酸と似ている可能性があると判断できる人は、2つの化合物に興味を持ち且つ有機化学をある程度以上に理解している人に絞られるだろう。だが、似ている可能性はあるのである。ルヌラリン酸をルヌラリン酸1のように描き直してアブシジン酸の構造式に重ねると、似ているかもしれないということが理解できるのではないだろうか。私の発想も、そうした重ね合わせが可能ではないかと気づいたところから出発している。
もちろん、平面構造式が重なるからそれで良いという話にはならない。全ての分子は平面構造を持っているのではなくでは立体構造を持つ。そこで、この2つの化合物について立体構造を求めてみた。当時は、大型の計算機でないとできなかったコンピュータによる構造計算が、ようやくPC上でできるようになったころである。乏しい研究費のなかで化学計算ソフト(CAChe)を購入し、当時としては最新型のマシンであったPowerMac 8100/80は妻の目を盗んで貯めた小遣いで購入した。そしてアブシジン酸とルヌラリン酸の安定構造の計算を行った。
アブシジン酸とルヌラリン酸の構造計算
購入したCACheには、MM2力場を使って安定構造を求めるプログラムと、MOPACと呼ばれる半経験的量子力学計算を行うプログラムが入っていた。当時は、MOPACよりMM2力場を使った分子力場計算の方が、計算も速かったし構造計算の精度も高かったため、この方法を利用した。連続した4個の原子が作る二面画をほんの少しずつ変えていられる構造を初期構造とし、その初期構造から周辺にあるローカルミニマムと呼ばれる安定構造を求めていくという方法である。多数得られてくるローカルミニマムの中で、もっともエネルギーの低いものが、最安定構造ということになる。
しかし、こうして求めた最安定構造は初期構造に依存する。適切な初期構造を使用できていない場合には、最安定構造を見落とす可能性がある。この可能性をできるだけなくすためには二面角の変化率を小さくすればいいのだが、そうすると膨大なメモリーと計算時間が必要となる。そこで、上記の方法とは別にMD法により、3次元のエネルギー平面をもとめ、ここで得られた初期構造からMM2力場を用いて最適化を行う方法で再計算を行ったが、得られた結果はほとんど同じものであった。
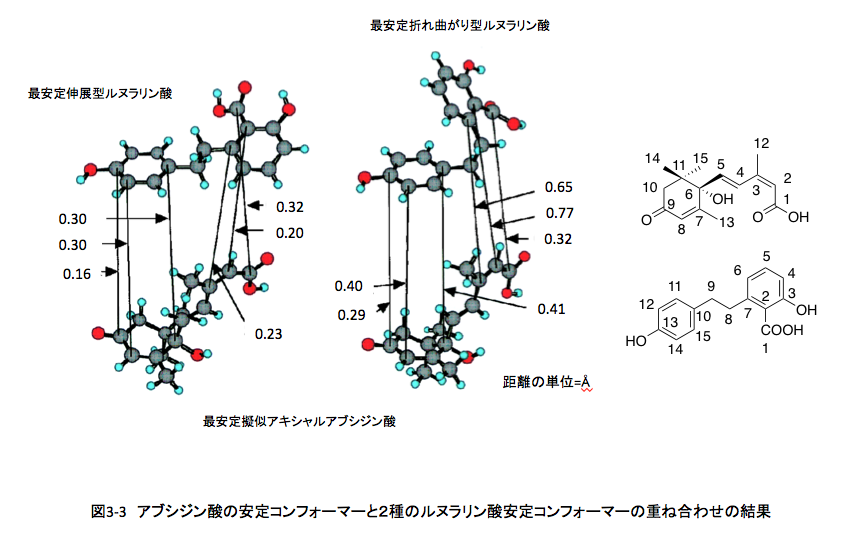
さて、アブシジン酸にはエネルギーレベルがほとんど違わない2つの安定な構造《擬似エクアトリアル型と擬似アキシャル型(右)》があることが分かったのだが、当時はこのどちらの構造がレセプターとの結合に適切であるかは分からなかった。後に活性型コンフォメーションは擬似アキシャル型であることが明らかになっている。一方、ルヌラリン酸は非常にフレキシブルな分子で、エネルギー的にほとんど差のない多数のローカルミニマム構造が存在するが、これらのローカルミニマム構造は2つのグループに分類できる。1つはベンゼン環の間に距離のある伸展型コンフォーマー群であり、いまひとつは2つのベンゼン環が近接して存在する折れ曲がり型コンフォーマー群である。
これら2つのコンフォーマー群からもっとも安定なコンフォーマーをそれぞれ1つ選び、アブシジン酸のもっとも安定で活性型である擬似アキシャルコンフォーマーと重ね合わせを行った結果を図3-3に示す。重ね合わせはアブシジン酸の活性発現に必要とされる炭素原子を含むC1, C2, C3, C6, C9, C10とそれらの炭素原子に対応するルヌラリン酸のC1, C2, C7, C10, C12, C13の原子間距離が最少になるようにした。(このナンバリングは分かり易くするために、IUPACの規則には準拠していない) 図の中の炭素間距離は、両化合物を重ね合わせたときの対応する対応する炭素原子間の距離を示しているが、得られた炭素原子間距離は1オングストローム以下に収まることが明らかとなった。この結果はアブシジン酸とルヌラリン酸が同一のレセプターに十分結合できる立体構造を持ちうることを示している。つまり、この2つの化合物は平面構造だけではなく、立体構造も酷似した化合物であったのである。
ルヌラリン酸の高等植物に対する作用
さてルヌラリン酸は、計算化学的にはアブシジン酸に酷似している。そうすると、高等植物は計算化学的には酷似しているルヌラリン酸をアブシジン酸として認識するかというのが次の問題となる。この問題は、ルヌラリン酸を高等植物に与えた場合にアブシジン酸を与えたときと同じ反応が起こるかどうかをみれば解決できる。そこで、ルヌラリン酸を高等植物に投与したときに起こる現象を、個体レベルでの反応から遺伝子レベルでの反応へと順次解析していくことにした。
1. レタス、クレスを用いた発芽生長試験とダイズ葉を用いた蒸散試験
レタスとクレスの種子を使って発芽試験を行ってみた。これはいわゆる「ぶっかけ試験」と呼ばれるラフな試験で、それぞれの種子に水を与えて発芽させるとき、その水の中にテストしたい化合物を溶かして与えるだけの簡単な試験である。ルヌラリン酸はなかなか水に溶けないため、ペトリ皿に敷いたろ紙に必要な量を含ませる方法で実施した。表3-1に示しているように、ルヌラリン酸は10-3M (258 ppm)の濃度で、これらの植物の発芽をある程度押さえると同時に、発芽した植物の根の伸長生長を阻害していた。アブシジン酸は10-5Mにおいても両植物の発芽と生長を強く阻害しており、ルヌラリン酸の活性はアブシジン酸に比較すると非常に低いものである。ルヌラリン酸の水溶性はアブシジン酸よりかなり低いため、活性が低くでるのはある程度予想していたとおりである。
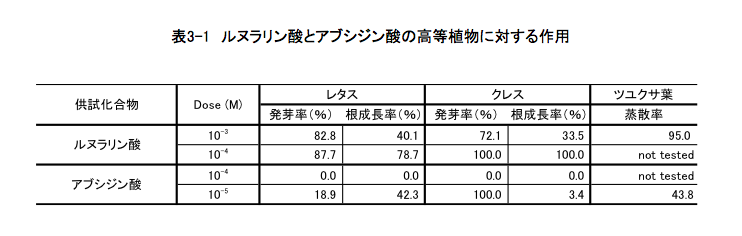
さらに、前節で述べたように、レセプター側との結合部位の形が似ているとしても、それ以外の部分の形が似ているかどうかは別の話である。従って、余り効かないからとここでめげる必要はない。弱い活性でもあると言うことを希望の種として先に進まないと、今まで考えてきた時間が無駄になってしまう。とはいうものの、ツユクサの葉を用いた蒸散試験での活性の低さは、いくぶん挫けそうになる結果である。確認のために、ルヌラリン酸とアブシジン酸でそれぞれ処理したツユクサの気孔を顕微鏡で観察すると、アブシジン酸で処理したツユクサの気孔はほぼ完全に閉じていたがルヌラリン酸で処理したものは、対照実験とほとんど変わらなかった。要するに、ルヌラリン酸は気孔を閉めさせる活性はほとんど持たないという結果である。
この結果には頭を抱えてしまったが、よく考えてみれば植物が気孔という器官を持ったのは、陸上に上がった後である。ルヌラリン酸からアブシジン酸へのリガンドの切り替えの後であると考えれば、こんな結果もあり得るかなと落胆した心を無理に励ましながら先に進むことにした。とはいっても、世の中にはこの程度の強さで植物の発芽と生長を阻害する物質は掃いて捨てるほど存在するため、この試験の結果から何か確定的なことはいえない。そこで、その頃アブシジン酸に特異的な活性といわれていたα-アミラーゼの誘導阻害試験を行うことにした。
2. α-アミラーゼの誘導阻害試験
アブシジン酸はいろいろな種類の植物の発芽を阻害するのだが、イネ科植物であるオオムギについては、その阻害のメカニズムが明らかになっていた。図3-4に示すように、オオムギの種子では発芽に際して胚におけるジベレリンの生合成が先行する。
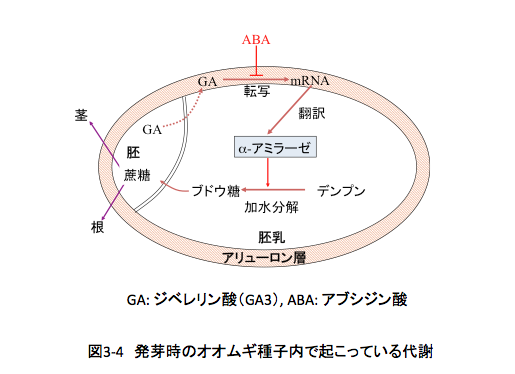
生合成されたジベレリンはアリューロン層へ移行し、α-amylase mRNAへの転写とその翻訳が行われα-アミラーゼの生合成がおこる。生合成され胚乳へと移行したα-アミラーゼ によって、胚乳に貯蔵されているデンプンの加水分解が起こりブドウ糖が生産されると、このブドウ糖が発芽時に必要とされるエネルギー源として使われるというわけである。そこで、発芽中のオオムギ種子にルヌラリン酸を投与して α-アミラーゼの生合成が起こらないことを確かめようというのがこの実験である。実際の実験の流れは、図3-5に示した。
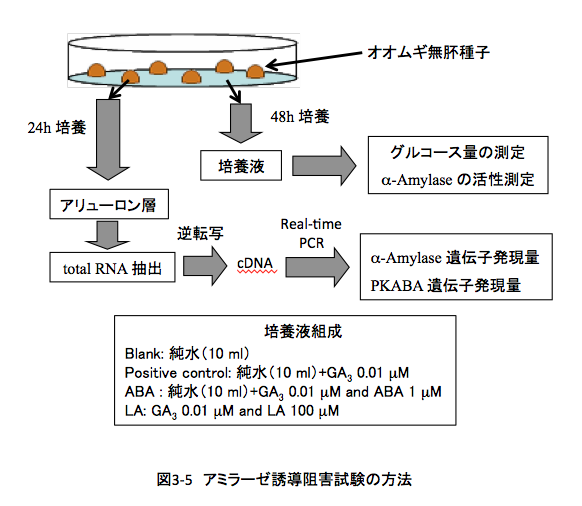
実験にはヒマラヤ種のオオムギと日本でつくられているハダカムギ(九州 hadaka 3rd)を使用した。滅菌したオオムギ種子を半分に切断する。胚が含まれるとそこで生合成されるジベレリンによる影響が出るため、胚を含まないように半分に切断した種子を使用する。この半切無胚種子では、胚が存在しないためにα-アミラーゼの誘導は起こらない。この無胚種子にたいして、外から10-7 Mのジベレリン(GA3)を与えα−アミラーゼの生合成を誘導するわけだが、このとき、アブシジン酸またはルヌラリン酸を共存させて一定時間培養し、培養液中に存在するα−アミラーゼの量を測ることでアミラーゼの誘導阻害を調べる方法をとった。初めの頃は、α−アミラーゼが生合成されていれば培養液中に還元糖(グルコースや麦芽糖など)が生成していると考え、培養液中の還元糖量をソモジネルソン法で測定した。還元糖量をグルコース量に換算した結果を、表3—2 に示した。
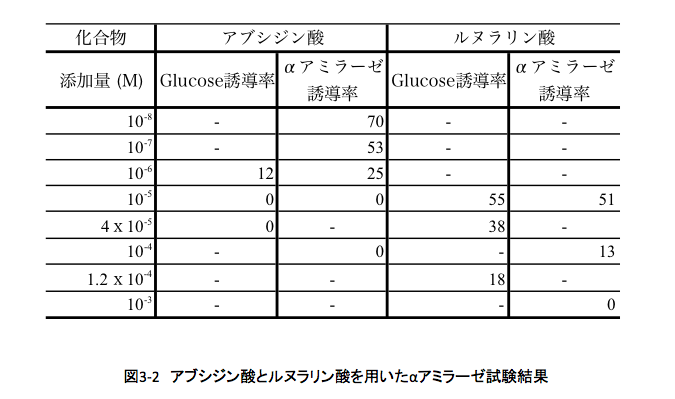
アブシジン酸が還元糖の生成を阻害するのは当然の話として、ルヌラリン酸もまた培地中の還元糖の生成を阻害していた。これは期待していたとおりの結果で、ルヌラリン酸の活性の低さも前述した「ぶっかけ試験」の結果から納得できる結果である。しかし、この試験には問題がないわけではない。もし、ルヌラリン酸がα−アミラーゼの阻害剤であった場合、α−アミラーゼは生合成されていても還元糖生成量は増えないのである。つまり、還元糖が生成しなかったことがα−アミラーゼが生合成されなかったことを一義的に意味するわけではない。ではどうするか?もちろん、ルヌラリン酸がα−アミラーゼの阻害剤ではないことを実験的に証明してもいいのだが、それは先に何の展望もないつぶしの実験である。たとえ、卒業研究のテーマだとしても、それでは担当する学生があまりにも可哀想である。そこで、もう少し考えた。培養液中のα−アミラーゼを測るのであるから、デンプン懸濁液をこの培養液を加えて生成する還元糖の量を見ればよいのだが、培養液にはすでに異なった量の還元糖が存在しているのである。透析をして還元糖を除くことも考えたが、これもスマートな方法ではない。
研究の進め方が、研究者の学問的バックグラウンドと利用できる研究機器に依存するのは当然だが、同時に彼の能力と個性にも大きく関係する。あまりにも稚拙な研究の進め方は、いくら結果が出ると分かっていてもやりたくないのである。報告を読んだ後で、「成る程」と思わずほほえんでしまうようなスマートなものにしたいという願望は、実現できたかどうかは別として常に持っていた。
ちょうどこの頃、次に述べるイムノアッセイ用にマイクロプレートリーダーを購入していた。この機器は、マイクロプレート上にある96個の穴に入っている溶液の吸光度を高速で測定できる。デンプンは水には溶けないが生成してくる麦芽糖やグルコースは水に溶ける。では、デンプンの懸濁液をつくっておいて、この液にα−アミラーゼを加えれば、時間とともに透明度が増し吸光度が減少することが期待できる。しかし、やってみるとデンプン粒子が沈殿してしまうため、データのバラツキが大きくて使い物にならなかった。振り混ぜながら測れば良さそうだったが、残念ながら私が購入したマイクロプレートリーダーには振とう装置はついていなかった。手で振って測定してみたが、やはりデータがばらついてしまう。いろいろと試行錯誤した結果、ゲランガムという植物の組織培養に使われる透明度の高い凝固剤を使うとデンプン粒子の懸濁状態を維持することができるようになった。このゲル上にアミラーゼ試験で得られた培養液を加え経時的に濁度を測定することで、α−アミラーゼの活性を測定する系をつくった。この方法で得られた結果も表3-2に示している。ルヌラリン酸の活性はアブシジン酸の活性にはるかに及ばないとはいえ、ここまでは思惑通りの結果である。
当時、このアミラーゼ試験はアブシジン酸に特異的な試験として認められていたので、ルヌラリン酸はアブシジン酸と同じ作用を持つ(同じレセプターに作用する可能性が高い)として偉そうに報告はしたのだが、 いくぶん以上に靴の上からかゆい部分を掻いている感がしないでもない。さらに、この2つの実験を通して、実験データのバラツキがかなり大きい。この実験は、非常に丁寧な女子学生(Oさん)がやってくれたもので、実験を行うヒトに問題があるとは思えない。実験を行う季節に伴う種子の生理的条件の相違、種子を半分に切るときの位置に伴う半切種子の体積など、変動をもたらす要因が多すぎるのである。報告を書くときは、複数回、かつ3連あるいは5連の並行実験を行い正しいと思われる結果を選んだのだが、時々異常なデータが得られると、仮説全体を否定したくなる場合もあり精神的によろしくない。確実に自信を持って判断するためには、もう少し発現系の上流で調べる必要があると考えた。
では次に何をすれば、両者が同じレセプターに作用していることを証明できるか。考えてみれば簡単である。高等植物からアブシジン酸レセプターを、下等植物からルヌラリン酸レセプターをとり、バインディングアッセイ(レセプターと化合物が結合するかどうかを調べる試験)をすればよい。とはいえ、これでは議論が逆転している。レセプターがとれているのであれば、バインディングアッセイさえ行えば今まで述べた試験はいらないのである。レセプターがとれないから苦労しているのである。(アブシジン酸の真のレセプターらしきものが2009年になってようやく報告された。もちろんルヌラリン酸レセプターについての報告は未だない。)では、レセプターアッセイのモデルとなるような研究はできないのか。生物側からみたときアブシジン酸とルヌラリン酸はどのように見えるかという問題である。あれこれと考えた末に、まずこの2つの化合物を、動物の免疫系はどのように認識するのかをみることにした。
3. エンザイムイムノアッセイによるアブシジン酸とルヌラリン酸の交差性の検討
この方法は免疫学と酵素化学の知識を組み合わせたもので、感度、特異性とも非常に高い方法であり、説明はいくぶん複雑になってしまう。面倒だし興味がないと思われる方は操作の部分を読み飛ばして結論に行って頂いても結構である。
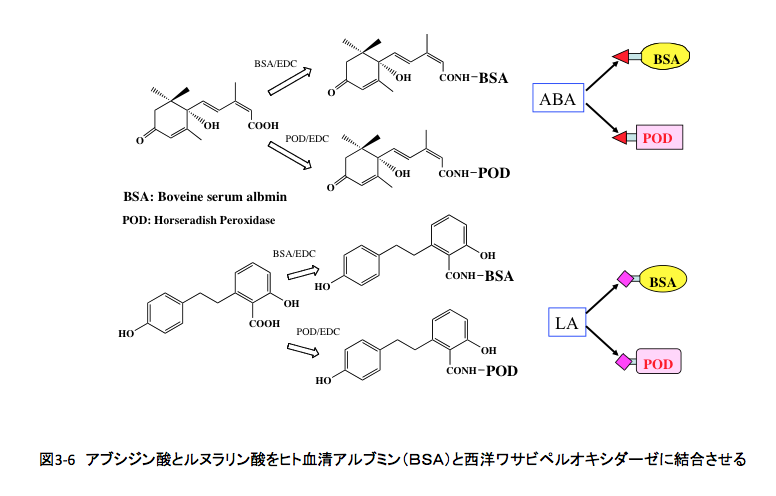
図3-6に示すように、アブシジン酸に存在するカルボキシル基を水溶性カルボジイミドである1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド塩酸塩で活性化した後、ウシ血清アルブミン(BSA:Bovine serum albumin)に存在する遊離のアミノ基と反応させた。アルブミン分子中には607個のアミノ酸残基を含んでいるが、その中には塩基性アミノ酸残基であるリジン残基が59個、アルギニン残基が26個存在する。塩基性アミノ酸残基中のアミノ基がアブシジン酸の活性化されたカルボキシル基と結合するわけだが、このアミド結合したアブシジン酸部分をエピトープ(抗体が認識して結合する抗原の特定の構造単位)として利用しようと考えたわけである。
このやり方では、反応するのはどのアミノ基であるかを正確に制御することも知ることもできないが、とにかく、アブシジン酸で修飾されたアルブミンが生成する。(この場合の修飾とは元のタンパク質分子が脂肪酸や糖など他の分子と結合することを意味する。さらに、本当に結合したかどうかは、次の実験で、ブシジン酸の部分をエピトープとして認識する抗体ができたかどうかで判断せざるを得なかった。有機合成の分野では、NMR、MS、IR、UVなどの機器分析で完全な構造を決めなければ先に進めない。その分野で研究してきた私にとって、このあやふやさはかなりな心理的ストレスになった事を記憶している。)
つぎに、アブシジン酸をウシ血清アルブミンと結合させた同じ方法を用いて、西洋ワサビペルオキシダーゼの修飾を行った。アブシジン酸のカルボキシル基を活性化した後、西洋ワサビペルオキシダーゼと反応させ、アブシジン酸が結合した西洋ワサビのペルオキシダーゼを得た。(この実験においても、得たと言っても得たという十分な証拠があるわけではない。分子量が40,200のタンパク質にアブシジン酸がいくつか結合しても電気泳動で、明確に確認することは難しい。この時期、MALDI-TOF MSでもあれば、結合したアブシジン酸残基数まで分かったかもしれないが、次の実験に使ってみていい結果が得られたら、得られたことの証明になるといういくぶん不明確な結果である。)このペルオキシダーゼは353個のアミノ酸残基を含む酸化酵素で、分子内に6個のリジン残基と15個のアルギニン残基を含んでいるので、これらのアミノ基の1~数個がアブシジン酸と結合していることになる。
ルヌラリン酸は水に対する溶解性が低いため、ちょっとだけ極性溶媒を加えるなどやり方を工夫して、アブシジン酸の場合と同じようにルヌラリン酸が結合した西洋ワサビペルオキシダーゼを合成した。
先の実験で作成した修飾アルブミンをアジュバント(抗原性補強剤)とともにマウスの腹腔と皮内に同時投与した。さらに、2週間おきに2回の皮下注射により免疫の増強を図った後、哀れなマウスを一日絶食させ、その血液を抜いたのである。血液から遠心分離によって血球部分を除いて得られた抗血清を以下の実験に使用した。(この部分の実験は宮崎大学のS教授に依頼して行った)
マウスの免疫系が修飾されたアルブミンを異物(タンパク性の高分子)として認識した場合、この異物に対する抗体が血清中に出現する。但し、ここで作られる抗体は1種類ではなく、異物である修飾アルブミンのいろいろな部分を認識する能力を持つ多種類の抗体混合物(ポリクローナル抗体)と呼ばれるものである。(図3-7参照)そしてこのポリクローナル抗体の中には、アブシジン酸の部分をエピトープ(抗原決定基)とする抗体が含まれている。このアブシジン酸を認識する抗体がルヌラリン酸をアブシジン酸として誤認識するかどうかを調べるのがこの実験の目的である。
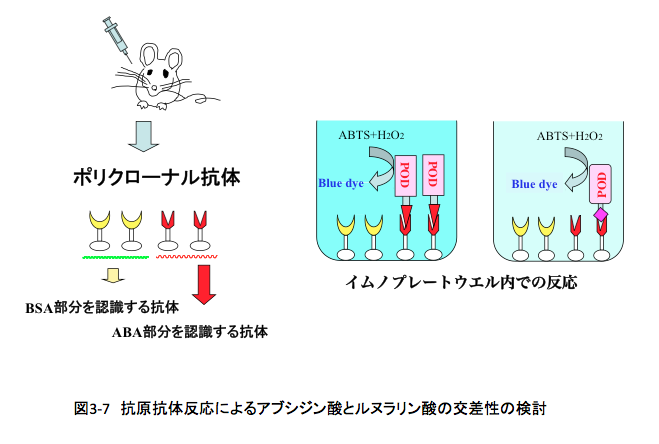
イムノアッセイ用マイクロプレート表面は、タンパク質と非特異的に結合する性質を持つ。先に得られたポリクローナル抗体を含む抗血清を、イムノアッセイ用マイクロプレート上のウエルに入れると、抗血清中に含まれる種々のタンパク質をウエルの表面に吸着されるが、このときアブシジン酸の部分をエピトープとして認識する抗体分子も吸着されることになる。抗血清を除去した後、何度もバッファーでウエルを洗浄した後、スキムミルク溶液を加えて残っている非特異的なタンパク質吸着点を被覆してタンパク質との結合能を殺してしまう。その後、このウエルにアブシジン酸またはルヌラリン酸で修飾した西洋ワサビペルオキシダーゼ溶液を分注した。ウエルに吸着された抗体中には、アブシジン酸の構造を認識する抗体が存在するため、アブシジン酸で修飾された西洋ワサビペルオキシダーゼは当然強く結合するのは当たり前である。ここで、アブシジン酸の構造を認識する抗体がルヌラリン酸をアブシジン酸とよく似た形(構造)であると認識すれば強く結合するし、似ていないと認識すれば結合は起こらないことになる。余分な修飾された西洋ワサビペルオキシダーゼを緩衝液でよく洗浄して除いた後、次にABTS (2,2′-Azinobis(3-ethylbenzothiazoline- 6-sulfonic acid ammonium salt)を発色剤として含む過酸化水素溶液をウエルに加えて37℃で30分反応させる。西洋ワサビペルオキシダーゼは過酸化水素の存在下にABTSを酸化して青い色素を生成するため、抗体と修飾された西洋ワサビペルオキシダーゼの結合が起こってればウエル内の溶液が青くなるはずである。(図3-7参照) 反応終了後に、シュウ酸溶液でHRPを不活性化させた後、各ウエル内の溶液の吸光度を405 nmで測定し、図3-8に示す結果を得た。
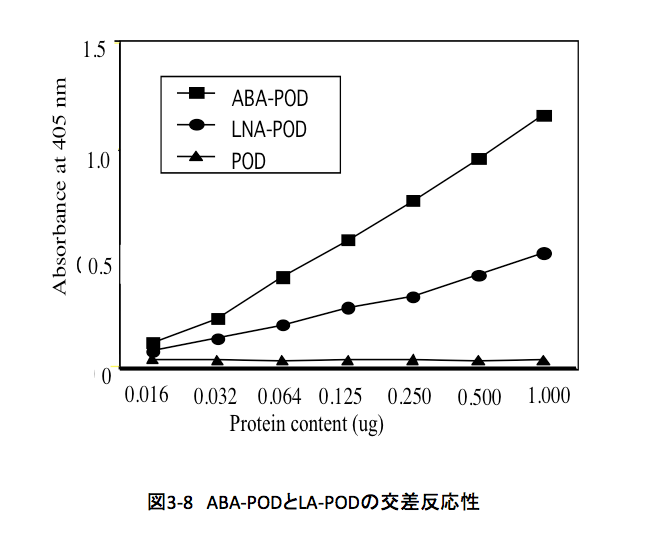
得られた結果は、図3-8に示すようにルヌラリン酸をエピトープとして持つHRPがABAをエピトープとして持つHRPの約2分の1の結合能を持つことを示している。この実験で採用した方法は、ELISA (Enzyme-Linked ImmunoSorbent Assay)の直接吸着法と呼ばれる方法である。確認のために、サンドウィッチ法を使用してみたが、この場合も高い交差性が検出された。これらの結果は、多様な異物に対してきわめて高い識別能を持つマウスの免疫系が、アブシジン酸とルヌラリン酸をよく似た構造を持つ物質であると認識したことを意味している。生物側からみた両化合物の類似性を支持するデータとしてとても有意義なデータと考えて良いだろう。がしかし、いまひとつ隔靴掻痒の感は免れない。もう少し直接的な証明はないのだろうか?
4. α−アミラーゼmRNA誘導試験
少し詳しくα−アミラーゼ誘導試験のメカニズムを説明する。無胚半切種子にジベレリンを与えると、まずアリューロン層でα−アミラーゼmRNAへの転写が誘導される。生成したα−アミラーゼmRNAに対する翻訳が起こって α−アミラーゼが生合成されるのだが、アブシジン酸はこの反応の最初の段階であるα−アミラーゼmRNA誘導を阻害する。つまりDNAからRNAへの転写が阻害される。先の実験でルヌラリン酸が 最終産物であるα−アミラーゼの作用を阻害するという可能性は否定したとはいうものの、α−アミラーゼmRNAからの翻訳を阻害しても同じ結果を与えると思われる。つまりα−アミラーゼ誘導阻害試験だけでは、ルヌラリン酸がアブシジン酸と同じメカニズムで発芽を阻害しているかどうかは未だわからないことになる。ルヌラリン酸がアブシジン酸と同じメカニズムで働いていることを証明するには、ルヌラリン酸によってα−アミラーゼmRNAの誘導が阻害されていることを示せばよい。そこで、遺伝子レベルでの実証実験を試みることにした。
この実験においては先に述べた α−アミラーゼ誘導阻害試験と同じ実験系を用いた。つまり、胚を含まない半切種子に、ジベレリンを与えてα−アミラーゼmRNAを誘導させるとき、アブシジン酸またはルヌラリン酸を共存させて誘導されるα−アミラーゼmRNAの量を比較すればよいことになる。実際は培養済みの無胚種子からアリューロン層をとり、このアリューロン層からtotal RNAを抽出する。得られた total RNA から逆転写を行いcDNAとした後、リアルタイムPCR法を用いて α−アミラーゼmRNAの発現量をみればいいのだが、当時私の研究室にはリアルタイムPCR装置がなかった。そこで学生に負担をかけることではあったが、増幅回数をみながら手作業でPCRチューブを抜き取り電気泳動にかけるという手間のかかる実験をさせたことを記憶している。結果は図3-8 に示しているが、PCRで25回増幅した結果を示している。
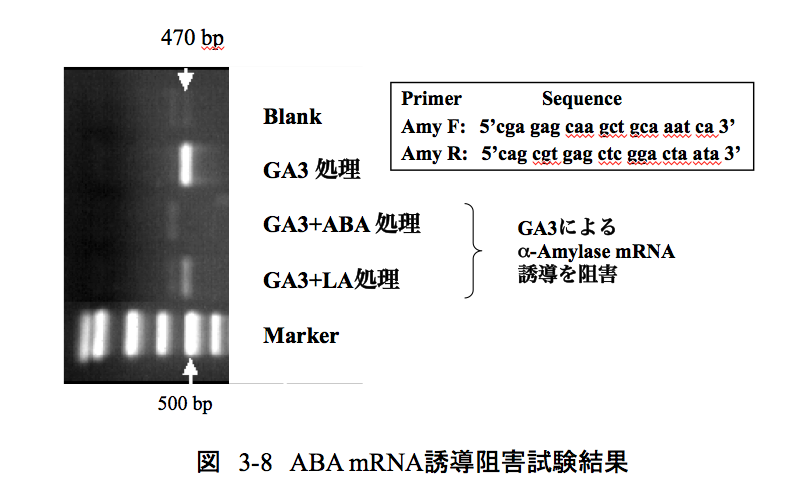
図に示したプライマーを用いるとアミラーゼ遺伝子に由来する470 bpのフラグメントが増幅される。10-7MのGA3で誘導をかけたオオムギにおいては、図に示すように大きな470 bpのバンドが見られる。このとき10-5Mのアブシジン酸を共存させると、470 bpのバンドは全く検出されない。一方、10-4Mのルヌラリン酸を共存させた場合は予想通り薄いバンドが検出できた。この結果は、ルヌラリン酸が、mRNAへの転写段階で働くアブシジン酸と同一のメカニズムでオオムギの発芽を阻害していることを示す明確な証明であり、私にとってはとても重要な結果であった。
5. PKABA誘導試験
近年、オオムギの発芽で働いているジベレリンとアブシジン酸の関連が、もう少し詳しくわかってきた。(図3-9参照)ちょっと面倒だが、付き合ってほしい。
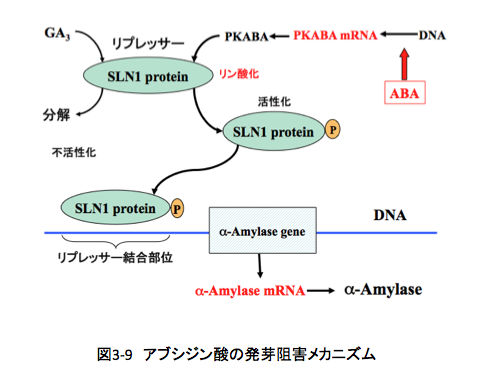
発芽に際して、オオムギではSLN1と呼ばれるタンパク質がジベレリンによって誘導される。アブシジン酸が存在しないときは、このタンパク質は何の作用も持たず(現在わかっている範囲での話)、自然に分解され発芽が進行する。一方、アブシジン酸が存在すると、アブシジン酸に特異的なリン酸化酵素(PKABA)の生合成が起こる。このPKABAはジベレリンで誘導されたSLN1タンパク質をリン酸化する能力を持つのだが、SLN1タンパク質はリン酸化を受けることで α−アミラーゼの遺伝情報があるDNAの上流に存在するリプレッサーに結合する能力を獲得する。その結果、リン酸化SLN1タンパク質はリプレッサー結合部位に結合し、 α-アミラーゼmRNAへの転写を阻害する。そうするとα−アミラーゼが生合成されないために、発芽が止まるというメカニズムである。
この筋書きに従えば、ルヌラリン酸もPKABAを誘導する可能性をもつ。方法は先に述べた逆転写に続くPCR法を用いればよい。結果を図3-10に示したが、やはりアブシジン酸よりは弱いもののルヌラリン酸がPKABAを誘導することが証明できた。

ここまでの実験全体を通しての結論は、ルヌラリン酸はα-アミラーゼ誘導阻害を通してオオムギの発芽を阻害する。その阻害はアブシジン酸と同じように、PKABA遺伝子の誘導を通して αアミラーゼの生合成を阻害し、オオムギ種子の発芽を制御するメカニズムにより起こるということになる。これは、ルヌラリン酸とアブシジン酸の分子構造が、計算科学的によく似ているだけでなく、マウスの免疫系も両分子をよく似た分子として認識するという結果と相補的な関係にあると考えられる。
今までの話は、ルヌラリン酸の高等植物に対する作用についての話であった。「では、アブシジン酸は下等植物に対してルヌラリン酸と同様な活性を持つのか?」という問いが等価な問いとして存在する。しかしながら、1990年代中頃まではアブシジン酸が下等植物に含まれるかどうかが議論されていたころで、藻類や苔類の内生量もわからない状況であった。当然のことであるが、下等植物でのアブシジン酸の作用についてもまだ未知の部分が多く、適切な生物試験法もなかった。しかし、何か一つでもデータが欲しいと考え、困ったときの「ぶっかけ試験」を行ってみた。
6. ゼニゴケのカルスの生長阻害試験
実験対象にしたのはゼニゴケのカルスである。アブシジン酸とルヌラリン酸を、それぞれ10 ppm、30 ppm を含むMurashige & Skoog 培地をつくり、これにゼニゴケのカルスを移植してみた。25℃、12時間明の条件下で15日間培養を続けたときの写真を図− に示した。ルヌラリン酸はセニゴケから単離された生長阻害物質でありゼニゴケカルスの生長を阻害するのは当然であるが、図に示すようにアブシジン酸もルヌラリン酸と同程度の生長阻害活性を持つことが明らかになった。この結果を基に、もう少し遺伝子側からの研究をすべきであったが、当時の研究環境では進めることができなかった。とはいえ、アブシジン酸とルヌラリン酸の生物活性の間に交差性があることは多分確実と思われる結果である。

アブシジン酸とルヌラリン酸がどうやらよく似ているらしいことは、今までの実験である程度証明?されたわけだが、ここまでは序章にすぎない。この二つの化合物はいかなる関係にあるのかという新しい疑問が出てきたわけである。その問いに答えるには歴史的視座からの考察が必要となる。どのような物語が可能になるのか、次の章から考えていくことにする。
2019/01/15
