この経験を若い学生さん達に共有してもらいたいと願っている。そこで蛇足と分かってはいるが、解糖系を生物有機化学的見地から少しばかり丁寧に描いておきたい。一般の方々は読み飛ばされて、いや読み捨てられて結構であるが、少し詳しく理解したいと考えている真摯な学生さん達には有益だと考える。大学を中途退職して10年程経ったのにまだこんなことを言い続ける、つくづく教えることがというより、伸びていく若者を見るのが好きだったのだなと思う。
まずグルコースについてである。グルコースは水に溶かすと、図2に示すよう3種の混合物として存在する。(量的に少ないのでフラノース型は無視する)そして下図におけるⅠ、Ⅲ、Ⅳの式で書いてある場合が多い。有機化学を十分にわからない段階でこういわれると、解らんと壁を作ってしまう学生が多い。少しかみ砕いて書いてみよう。
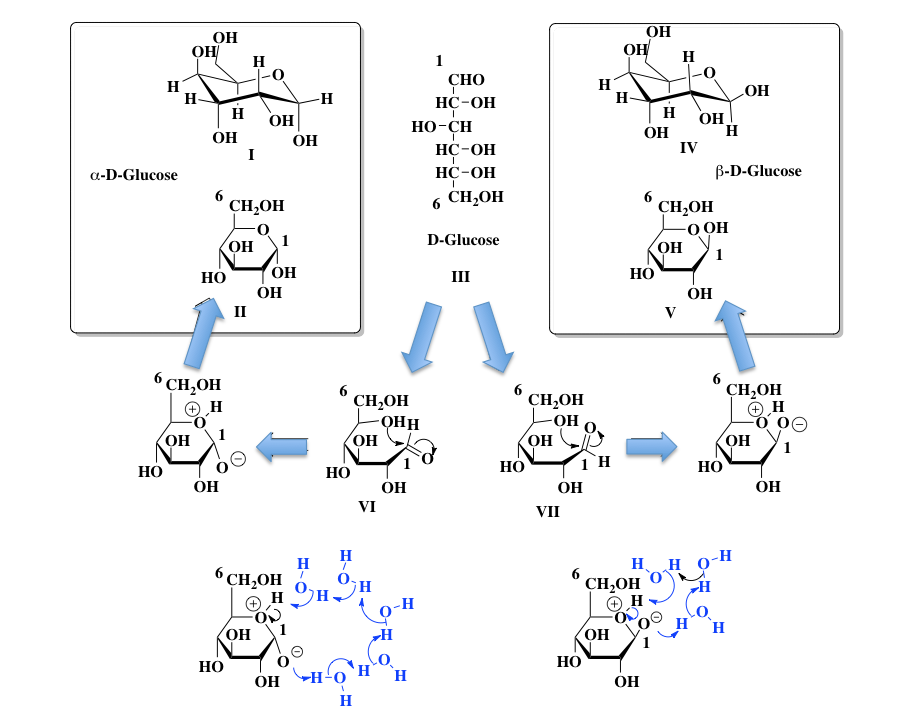
この図においてⅠとⅡ、ⅣとⅤは同じものである。とにかく水に溶かすと、グルコースは Ⅰ、Ⅲ、Ⅴ の構造間で相互に変換しながら存在している。色んな書籍の中でよく見かけるのはHaworthの投影法にしたがって描かれたIIとVの式、及び Fisher 投影法に従って描かれた III の式である。I と IV は、立体化学を意識して描かれたものである。では II と III と V は相互に違うのか、それとも同じものかという疑問を持たれると思うのだが、答えは難しい。こうして形を固定して描いてしまえば違うものである。しかし、次の瞬間には Ⅲ を経由して相互に変換しているという立場に立てば、同じものであり得るという禅問答のような答えが正しい答えとなるだろう。
グルコースは還元糖でありフェーリング反応を起こすし銀鏡反応も起こすことが知られている。この D-Glucoseの還元性は、III式の1位にあるアルデヒド基が原因になっている。では、II、V で示す α-D-グルコース や β-D-グルコース にはアルデヒド基がないため還元性は持たないかといえばそんなことはない。それらを水に溶かすと、I(α-D-Glucose 約 37 %)、III (D-Glucose ごく微量)、V (β-D-Glucose約 63 %)の平衡混合物となってしまう。そして、ごく微量存在するD-グルコースが、還元性を示す原因となるのである 。その異性化のプロセスを、下段に分かり易く描いてみた。
そこで中央のD-グルコースをHaworthの式をイメージしながら描くと、下段に示した左右二つの式(VIとVII)を描くことができる。一見、1位の形が違うのではと思われるかもしれないが、1-2位の炭素間はsp3混成軌道間の結合であるため、自由回転(Free rotation)が可能であり、これらの2つの式は同じ物質を示している。ここで、5位の水酸基の酸素分子が1位のカルボニル炭素を求核攻撃するとヘミアセタールが生成し、環状構造が出現する。この時、アルデヒド基のカルボニル基が向いていた方向によって、環の1位に出現する水酸基の方向が確率的に決まってくる。
初学者が迷うのが水素イオンの処理である。5位の水酸基の酸素分子が1位のカルボニル炭素を求核攻撃するに際して、水酸基の水素は水素イオンとして外れなければならない。その水素イオンは、攻撃を受け立ち上がったカルボニル基のマイナスに荷電した酸素に移動しなければならない。慣れれば何でもなく脳内で処理できるのだが慣れない間は何となくこの水素イオンがこっちの酸素に移動しなければならない。結構遠いな、などと考え込んでしまうらしい。グルコースは水に溶けている。その時、水素結合で連なった水分子のクラスターみたいなものが、水素イオンの見かけの移動を担っていると考えれば良い。図1の下部に書いた概念図を参照して欲しい。左側の図がα-D-グルコース、右側がβ−D-グルコースの場合の図である。これらの図が正しいというわけではなく、挟まってくる水分子はいくつでも良い。
さてそこで、解糖系にはいることにする。図3に解糖系の最初の部分、グルコースからフルクトース-1、6-ジリン酸までの反応を示す。中段の列が通常描かれているもので、上下に各反応のメカニズムを示している。ここで、Enzyme-B: は酵素の活性部位に存在する塩基性部位を示し、Enzyme –A-Hは酵素の活性部位に存在する酸性部位を示す。これもまた初学者が惑うことなのだが、Enzyme –A-Hから水素イオンが外れるとEnzyme –A:−イオンとなり(−記号は上付き文字)これは塩基として働くし、水素イオンを受け取ったEnzyme-B: H+(+記号は上付き文字)は酸として働くことになる。
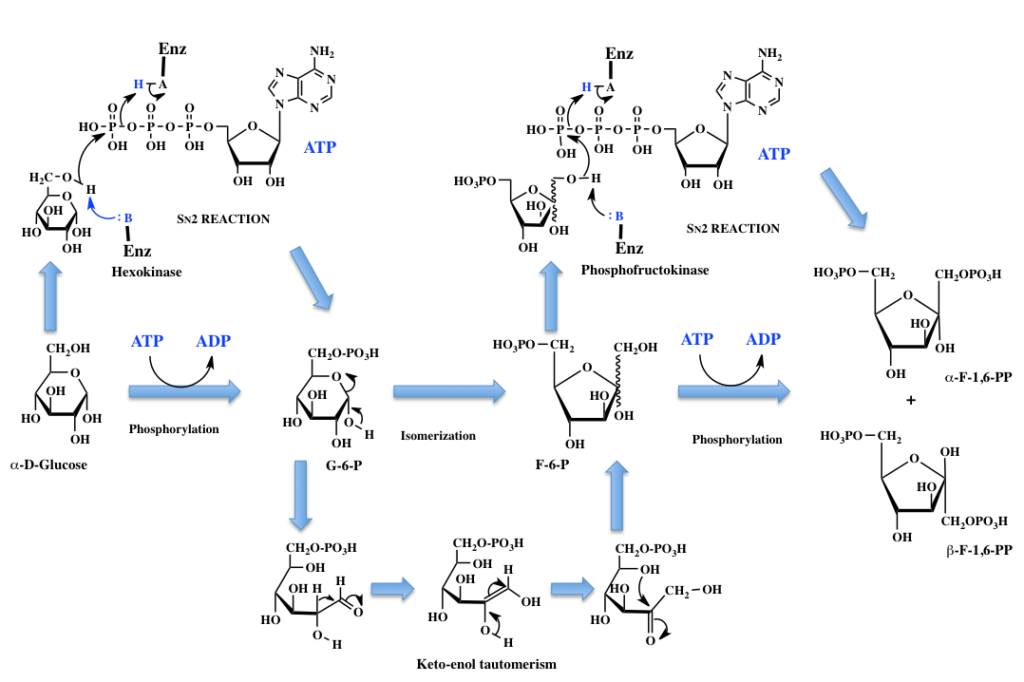
図3 α-D-グルコースからフルクトース-1,6-ビスリン酸まで
グルコースからグルコース-6-リン酸(G-6-P)への反応は、グルコースの6位の水酸基とATPの γ 位のリン原子との間に起こる2分子求核置換反応《SN2反応》により進行する。この反応において酵素は反応の進行を促進すると同時に、二つの基質を補足してグルコース6位の水酸基とATPの γ 位のリン原子間で反応が起こるように配置するわけだ。
生成したG-6-Pは、まずヘミアセタール環が解列してできたαヒドロキシアルデヒドがケト-エノール互変異性体であるcis-エンジオール中間体を経由して鎖状のフルクトース-6-リン酸に異性化した後、生成したカルボニル基と5位の水酸基の間でヘミアセタール環(フラノース環)が形成されることで完成する。この反応においては描きにくかったので省略したが、ホスホヘキソースイソメラーゼの活性部位内の塩基性部分が、反応において脱離するプロトンを攻撃し、そのプロトンを生成した酸素アニオンに供与していると考えて良い。この際、グルコースの環化と同じように4位と5位の炭素間の結合が自由回転であるため、生成するF-6-Pはα体とβ体の混合物になるらしい。従って中段のF-6-Pには結合を波線で示した。F-6-PからF-1,6-PPヘの変換は、α体を例にしたように描いているが、やはりF-6-Pの1位の水酸基がATPのγ位のリン原子を攻撃して起こる起こる2分子求核置換反応《SN2反応》である。生成したF-1,6-PPは多分α体とβ体の混合物になるのだろう。書籍によりα体で描いてある場合とβ体で描いてある場合が存在する。生体内の話であるため、水中にあると考えて良いだろう。とすれば、この両異性体間においても相互変換が起こっているため、簡単にこちらだと決めることは難しそうだ。今後は、そうしたことも頭に入れた上でα体の形で描いていくことにする。
これくらい丁寧に描いてある教科書があったら、私ももう少し早い時期に理解が進んだかもしれない。それはお前の理解力の低さに由来するものだと言われればそうかと言う以外に言葉はないが、話を聞いていると多くの人も解っていないことが言葉の端々から感じられる。多くの人の中に生化学教育を担っている方々が散見されるのが残念である。
ただし、以上の描き方では、酵素の反応に対する関与については殆ど述べていない。糖分子にはいくつもの水酸基があるのに、何故特定の水酸基のみが反応に関与するのか、反応の促進はいかに起こるのか、などという問題に踏み込まなければならないのだが、そこまでやると何が問題であったのかさえ霞んでしまうだろう。生物における酵素反応の奥はもっと深いということで、ここは納めておくことにしよう。では次の段階、すなわち、フルクトース-1,6-ジリン酸から3-ホスホグリセルアルデヒドと1,3-ジヒドロキシアセトンリン酸への反応に進むことにする。
解糖系における反応の中で、この段階がもっとも解りにくいのではないかと思う。ここで起こっている反応はレトロアルドール縮合と呼ばれるものだが、レトロアルドール縮合はよく知られたアルドール縮合の逆反応である。まず図4にアルドール縮合の説明から描いておくことにする。上段にはアルドール縮合の端緒と言うべき反応を描いている。アルドール縮合に分類される反応は無数といっても良い程存在し、アルドール縮合に分類される反応をまとめたAldol condensationというタイトルを含む書籍は、数十種を優に超えるだろう。そのアルドール縮合の原型とされている反応が、図に示したアセトアルデヒドからアルドールを生成する反応である。有機化学の入門書においては「α-水素をもつケトンまたはアルデヒドが縮合して,β-ヒドロキシケトン,もしくはβ-ヒドロキシアルデヒドを生成する反応」などとごく簡単に説明して、2分子のアセトアルデヒドからアルドールが出来る反応と、それに続くアルドールから脱水によってクロトンアルデヒドが副生する図が示されている場合が多い。
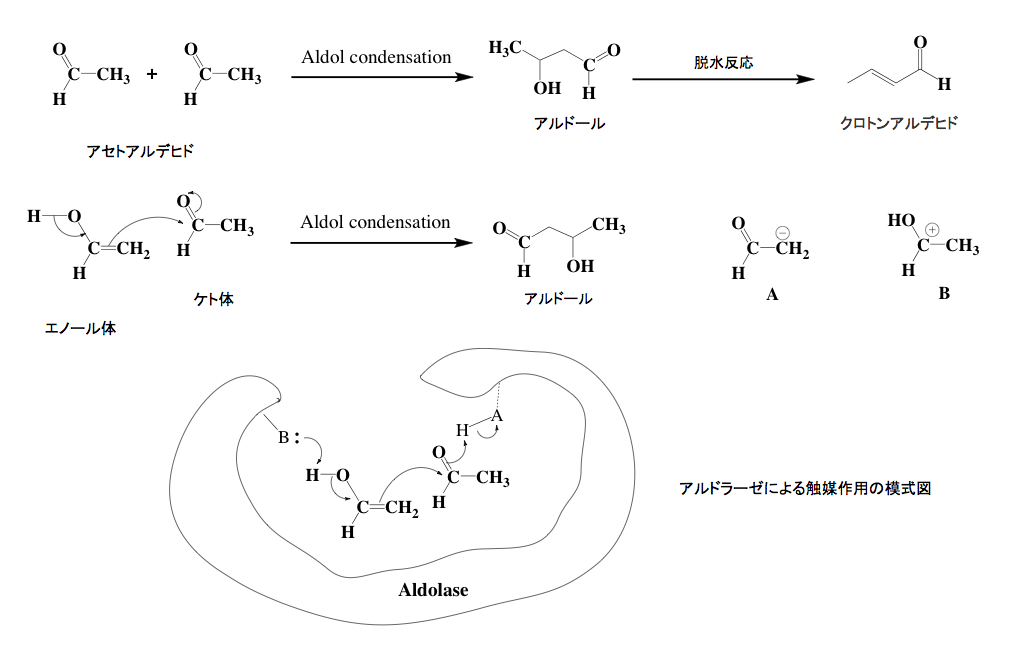
だがこの反応はそんな説明で済むようなものではなく、炭素−炭素結合を作る極めて重要かつ応用範囲の広い反応である。とはいえ、ここは有機化学の話をする場ではない。少しだけ有機電子論の立場からアルドール縮合について説明し、目的のレトロアルドール縮合へと話を続けたい。アセトアルデヒドはカルボニル基の隣の炭素上に水素原子が存在する。従ってケト-エノール互変異性体が存在するわけだ。中段に描いた反応式において左側がアセトアルデヒドのエノール体、右側がケト体である。エノール体がケト体に異性化しようとするとき、瞬間的に2位の炭素がアニオンに変わると考えて良いだろう。そのアニオンが、隣のケト形のカルボニル炭素を攻撃して炭素−炭素結合が生成すると同時に、腑に荷電した酸素にプロトンが結合してアルドールとなるわけである。
この反応は塩基性触媒、あるいは酸性触媒の存在下に加速されるのだが、塩基性の触媒は右に示したA即ち炭素アニオンの生成を加速し、酸性触媒はB即ちカルボカチオンの生成を加速することで反応速度を上げている。蛇足だが、仮想的アルドラーゼは下段に示すように、活性部位に存在する塩基性部位と酸性部位が協奏的に働き驚くほどの反応速度を達成していると考えられる。但し、これは模式図にすぎない。反応メカニズムがそうなっているという意味での話であって、実際に生物中にアルドールそのものを形成する酵素が存在するかどうかは分からない。(電気陰性度の差によるカルボニル基の立ち上がりとか、ルイス式による構造式の表示と形式電荷などについては理解しているという前提で描いている)
とりあえずアルドール縮合は分かったとして、先に進むとすれば、この反応の逆反応がレトロアルドール縮合である。この開裂反応はまだ未熟だった私を最も悩ませた変換反応の一つである。この反応において、フルクトース-1,6-ジリン酸はレトロアルドール縮合を起こし、1,3-ジヒドロキシアセトンリン酸と3-ホスホグリセルアルデヒドへと解列するのだが、当時は何が起こっているのか皆目分からなかった記憶がある。
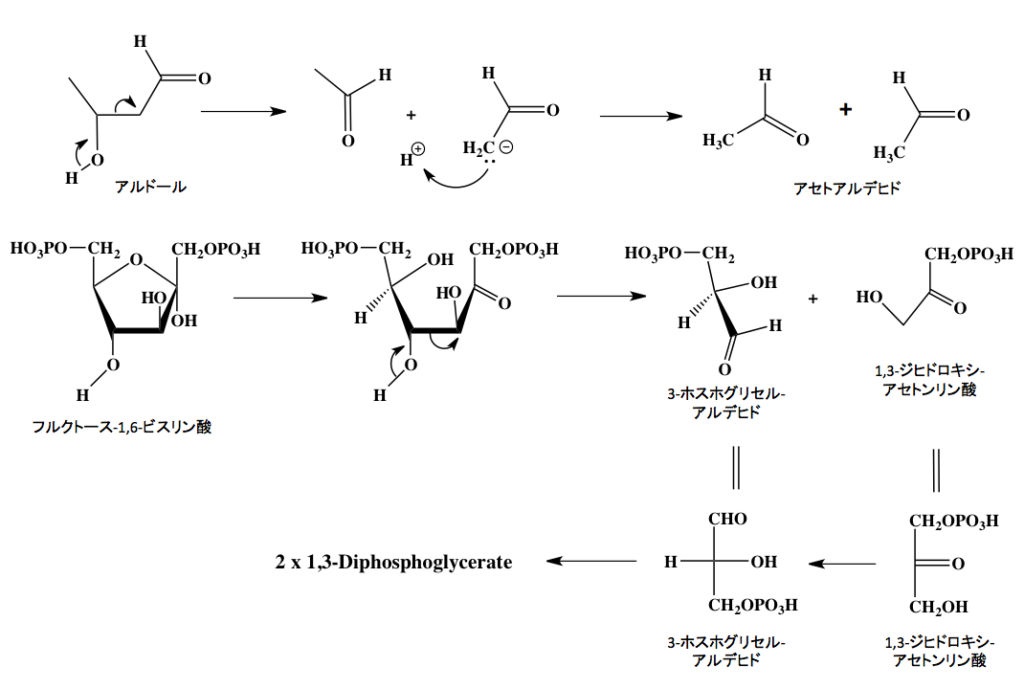
図5の上段に示すように、アルドールのβ位の水酸基からカルボニル基が再生するとき2位のC−C結合が切れ、左側の部分からアセトアルデヒドが生成するのと同時に、右半分はアセトアルデヒドの2位の炭素原子上にアニオンが発生する。このアニオンが最初に外れたプロトンと結合して、もう一分子のアセトアルデヒドが生成すると考えて良い。その次の段に、上の反応の形に合わせてフルクトース-1,6-ビスリン酸のフラン環が開いた後、3位と4位の間で開列が起こるレトロアルドール縮合を示した。上下を見比べてもらえば分かりやすいだろう。
1,3-ジヒドロキシアセトンリン酸には不斉中心が存在しないためそのまま下段のように描いて不都合はない。一方、3-ホスホグリセルアルデヒドは2位の炭素が不斉炭素であるため、これをフィッシャー投影法で描き直してやると見慣れた投影式が得られる。この辺りの表記法については、分子模型を使って慣れるしか方法はない。不思議な物で、慣れれば脳内に浮かんだ分子が回転したり反転したりするようになるので、そこまで頑張って下さい。
最後に、1,3-ジヒドロキシアセトンリン酸はトリオースリン酸イソメラーゼによって3-ホスホグリセルアルデヒドへと異性化され解糖系の中に取り込まれていく。従って、ここから先は2分子が流れていくことになるのだが、この異性化はエノール性互変異性体を介して起こる異性化反応でありフルクトースとグルコースの相互変換とメカニズム同一である。一言付け加えるとすれば、この段階も立体選択的な反応で、生成物はD体のつまりフィシャー投影において水酸基が右側に描かれる3-ホスホグリセルアルデヒドであることは注意しておくべきである。(1,3-ジヒドロキシアセトンリン酸は上下を入れ替えて描いたほうが親切だったと思わないでもないが、上の段とのつながりもありこの形となりました。)
レトロアルドール縮合はアルドール縮合の逆反応である。またもや脱線するが、縮合反応の一般的な定義は、2つの分子が水、アンモニアなどの小さな分子の脱離を伴って新しい共有結合を生成する反応をいう。そうであるのにフルクトース-1,6-ジリン酸から3-ホスホグリセルアルデヒドと1,3-ジヒドロキシアセトンリン酸ヘの反応は、レトロアルドール縮合という縮合反応に分類されているにもかかわらず、実際はフルクトース-1,6-ジリン酸が3-ホスホグリセルアルデヒドと1,3-ジヒドロキシアセトンリン酸ヘ開裂しているのである。これは上記の定義に合わないのではないか。
「君は人の悩まないところで悩む才能を持っているね」とある人に褒められた(けなされた?)ことがあるのだが、まさにその通りである。こんなことで悩んでいると学習が進まない。でも、世の中には私のような若者がいるかも知れないと考えて以下の説明を付け加えておくことにする。
アルドール縮合の逆反応であるレトロアルドール縮合は、縮合反応ではなく開裂反応である。勘違いしないように書くとすれば、レトロアルドール反応として縮合という言葉を抜くべきであろう。要するに、人の悩まないところで悩む才能を持つ阿呆な著者がレトロ・(アルドール縮合)と切るべき所を、(レトロアルドール)・縮合と切ってしまい、この反応を縮合反応であると思い込んだのが迷走の原因であった。つまりレトロアルドール縮合とはアルドール縮合の逆反応であり、C-C結合の開裂反応である。
つづいて、3-ホスホグリセルアルデヒドから1,3-ビスホスホグリセリン酸への基質レベルでの酸化を伴うリン酸化反応である。
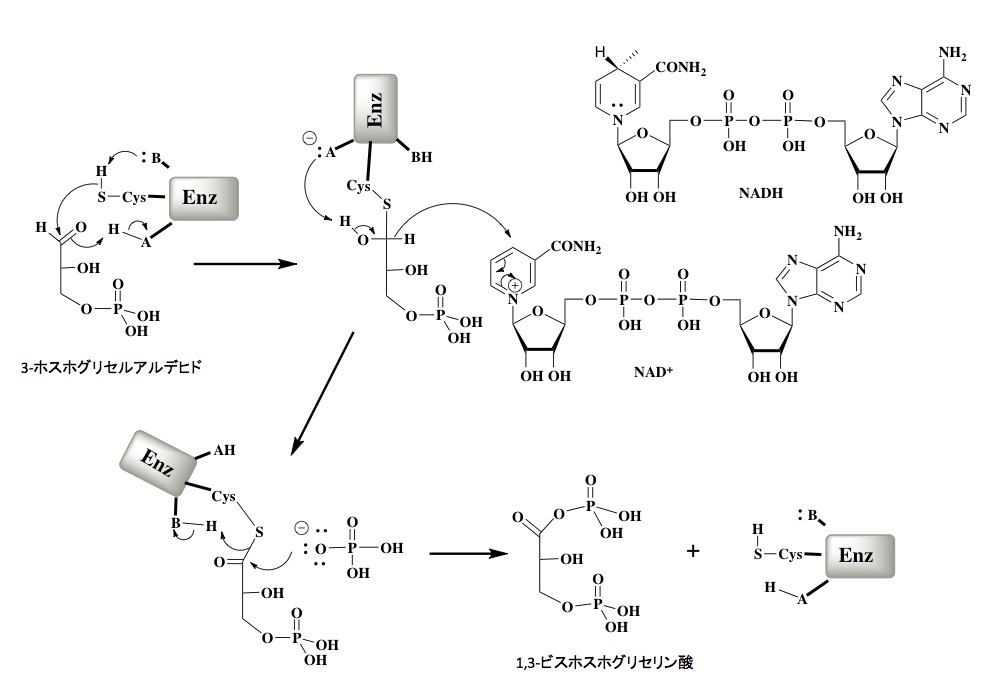
図6に示すように、この反応の初発段階は、3-ホスホグリセルアルデヒドデヒドロゲナーゼのシステイン残基にあるSH基が3-ホスホグリセルアルデヒドのアルデヒド基に付加する反応である。酵素内の塩基性部位がチオール残基を活性化し、カルボニル基への付加を加速する。この際、酵素内の酸性残基がカルボニル基の立ち上がりを促しているため、この付加反応は速やかに進行する。この付加反応で、酵素内の酸性残基と塩基性残基が入れ替わっている。−A:−で表示された塩基が1位に発生していた水酸基のプロトンを攻撃してカルボニル基の再生が起こるのだが、この時1位の水素がアニオンとなってNAD+のピリジン環の4位に求核的に付加する。この反応は、水に対して極めて不安定なヒドリドイオンが生体内で移動するという興味深い反応である。よく見ていただければ分かると思うが、−A:−でプロトン(H+)が抜かれ、ヒドリドイオンの移動でH−が抜かれている。両者を合わせると脱水素が起こっているため、この段階が酸化反応ということになる。次の段階では正リン酸イオンが反応性の高いチオールエステルのカルボニル基を攻撃した結果、切れていく硫黄アニオンが酵素分子内の−B:−を再生して酵素が元に戻ると同時に、目的物である1,3-ビスホスホグリセリン酸が生成することになる。
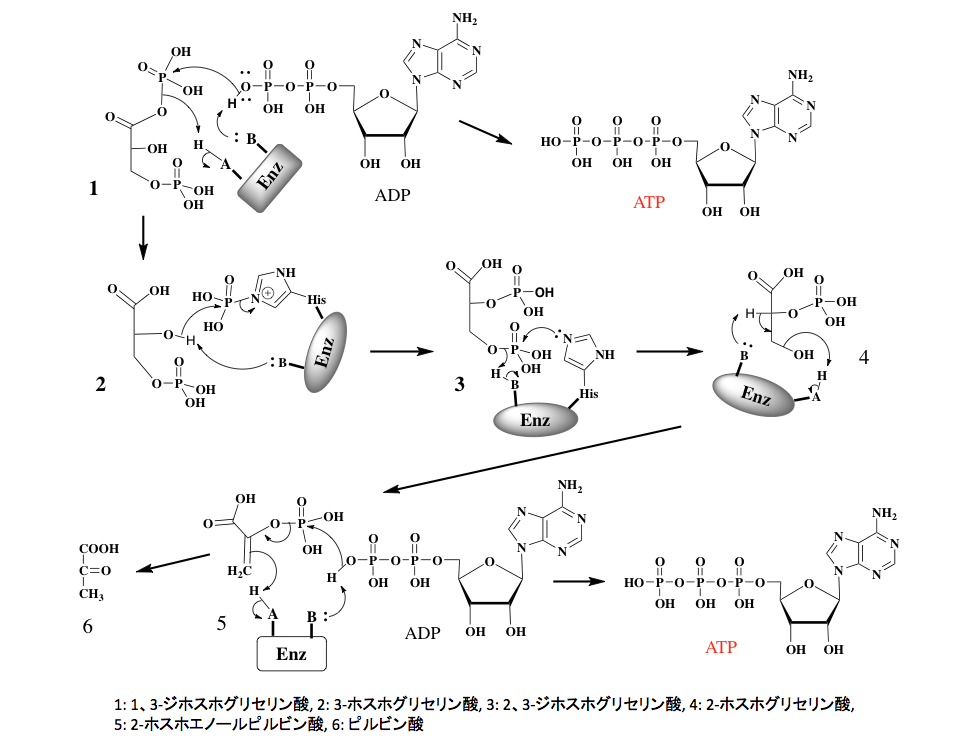
さて図7に示すように、ここで得られた1、3-ジホスホグリセリン酸のカルボン酸とリン酸の混合酸無水物は化学的に非常に反応性が高く、キナーゼの存在下にADP末端のリン酸基ををリン酸化してATPを生成すると同時に、3-ホスホグリセリン酸を与える。このステップがグリコリシスにおける最初のATP生産段階である。
次のステップは幾分ややこしい。ここでは脊椎動物、昆虫、藻類、そしてグラム陰性菌に主に分布している反応について描いておく。働く酵素はホスホグリセリン酸ムターゼなのだが、この酵素は分子内にリン酸化されたヒスチジン残基を持っている。反応のはじめの段階で、この酵素のリン酸基は3-ホスホグリセリン酸の2位のリン酸化に使われる。つまり2,3-ジホスホグリセリン酸が中間体になるのであるが、この中間体が生成すると直ぐに酵素の活性部位の形が変わり、酵素のヒスチジン残基は2,3-ジホスホグリセリン酸の3位のリン酸基を攻撃してリン酸化され元に戻ると同時に、2-ホスホグリセリン酸が生成する。従って、この2位のリン酸基は酵素のヒスチジン残基と結合していたものであり、初めに3位に存在していたリン酸基が転移したものではない。
次のステップはエノラーゼに触媒される脱水反応である。図7に示すように協奏的に脱水が起こり、極めて反応性の高い重要な代謝中間体であるホスホエノールピルビン酸が生成する。このホスホエノールピルビン酸はピルビン酸のエノール体に存在するエノール性水酸基がリン酸化された形の化合物で、ピルビン酸キナーゼの存在下にADPをリン酸化してATPを生産しながら解糖系の最終産物であるピルビン酸が生産されることになる。
できるだけ丁寧に記載しているので、興味のある方は全体を通してトレースして下さい。有機化学系の学生さんは、生化学反応が有機電子論的に描けることに納得して頂けると思うし、生化学系の学生さんは、生化学反応の基礎にある有機化学という学問に今少し目を向ける切掛けにして欲しい。老婆心からの発言です。とは言っても各図には不十分、場合によっては不正確な点があることは十二分に分かっている。気付いていないミスもあるだろうし、私が誤解している部分もあるかもしれない。しかし、お釈迦様が説くところの方便として受け取っていただければ幸いである。後は各自で補って欲しい。とにかく、2分子が流れる後半のプロセスで4分子のATPが生産される。この4分子のATPから前半で消費された2分子のATPを差し引いて、系全体のATP生産は2分子であると説明されているわけだ。
こうした形で理解した上で考える解糖系と、図1をとにかく丸暗記して答える解糖系には認識の上で隔絶した差があることを自覚していただければそれで良い。
次回は、蛇足から本論に戻り、この解糖系の理解の仕方が妥当であるかどうかについての議論を始めたい。蛇足の蛇足みたいだが、2分子のATPを投資すると、4分子のATPが収益として得られるという認識、まるで資本主義的理解だな。善し悪しの問題ではなくこうした説明に納得する感性を、我々は現代社会の枠組みの中で身に付けて来たのかもしれない。さらにだが、一番初めに投資するATPは何処にあったのだろう。
